
���� ��1������Ԫ���غ�����Ȼ��������Ȼ������ʵ���֮�ȣ���һ�������Ȼ������������������������ᷴӦ�����Ȼ�������������������������֮�䷴Ӧ�����Ȼ�����
��2����FeCl3��KClO��ǿ���������·�Ӧ��ȡK2FeO4��
��3��K2FeO4-ZnҲ������ɼ��Ե�أ�K2FeO4�ڵ������Ϊ�������ϣ�������FeO42-�õ��Ӻ�H2O��Ӧ����Fe��OH��3��
��� ��1���⣺��1��FeCl2��FeCl3�Ļ�������Ʒ��FeCl2���ʵ���Ϊx��FeCl3�����ʵ���Ϊy����x+y������2x+3y��=1��2.1���õ�x��y=9��1���Ȼ������ʵ�������=$\frac{9}{1+9}$��100%=9%�������������ᷴӦ�����Ȼ�������������������������֮�䷴Ӧ�����Ȼ�����
�ʴ�Ϊ��90%�����������
��2����FeCl3��KClO��ǿ���������·�Ӧ��ȡK2FeO4����Ӧ�����ӷ���ʽΪ��2Fe��OH��3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-��2Fe3++10OH-+3ClO-=2FeO42-+5H2O+3Cl-���ʴ�Ϊ��2Fe��OH��3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-��2Fe3++10OH-+3ClO-=2FeO42-+5H2O+3Cl-��
��3��K2FeO4-ZnҲ������ɼ��Ե�أ�K2FeO4�ڵ������Ϊ�������ϣ�������FeO42-�õ��Ӻ�H2O��Ӧ����Fe��OH��3���缫��ӦʽΪFeO42-+3e-+4H2O=Fe��OH��3+5 OH-���ʴ�Ϊ��FeO42-+3e-+4H2O=Fe��OH��3+5OH-��
���� ���⿼�����ʵ����ʡ��缫��Ӧʽ����д��Ϊ��Ƶ���㣬��ȷ�����缫�Ϸ����ķ�Ӧ�ǽⱾ��ؼ����ѵ��ǵ缫��Ӧʽ����д��ע���ϵ������Һ�������д����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��O2��Ӧ����ˮ | B�� | пƬͶ��ϡ������ | ||
| C�� | ľ̿�ڸ�������CO2��Ӧ����CO | D�� | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{��}$2KCl+3O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol•L-1 CH3COOH��Һ��0.1 mol•L-1NaOH��Һ�������� | |
| B�� | ��40mL0.2 mol•L-1��NaOH��Һ��ͨ��67.2mLCO2������� | |
| C�� | ��100mL1 mol•L-1NH4Cl��Һ�У�Ͷ��3.9gNa2O2 | |
| D�� | ��20mL0.01 mol•L-1Ma��HCO3��2��Һ�У�Ͷ��0.2g Ma��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
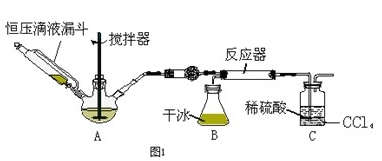
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K+��SO42-��NH4+��CO32- | B�� | K+��Ba2+��OH-��Cl- | ||
| C�� | Na+��H+��Cl-��SO42- | D�� | Na+��Mg2+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K+��Ag+��NO3-��Cl- | B�� | NH4+��Ba2+��Cl-��CO32- | ||
| C�� | H+��Ca2+��CO32-��NO3- | D�� | Na+��Al3+��SO42-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ܼ� | B�� | �����¶� | C�� | �����¶� | D�� | ����KN03���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
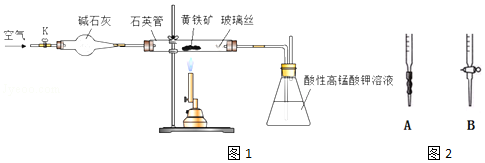
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com