
【题目】下列说法正确的是
A.均一稳定的分散系只有溶液
B.胶体和溶液、浊液的本质区别是能否产生“丁达尔效应”
C.一束平行光线照射FeCl3溶液时,从垂直于光线的方向可以看到一条光亮的通路
D.氢氧化铁胶体能吸附水中的悬浮颗粒并沉降,起到净水作用
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】现将200mL0.01mol/LNaOH与50mL某浓度的Ca (OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH﹣的物质的量浓度是0.016mol/L,则Ca(OH)2溶液的物质的量浓度是mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是( )
CH3OH(g) 达到平衡。下列说法正确的是( )
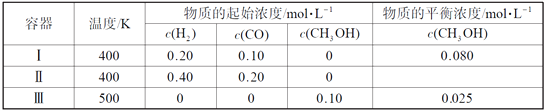
A. 该反应的逆反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保持洁净安全的生存环境已成为全人类的共识。
(1)家庭装修所用的复合板材中常会放出对人体有严重危害的物质,这种有害物质主要是指________(填名称)。
(2)天然水中含有的细小悬浮颗粒可以用明矾做进行净化处理,明矾水解得到的________可以吸附细小悬浮颗粒。
(3)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量.为控制大气中二氧化硫的排放,常采取的措施是在煤炭中加入石灰石粉末对化石燃料进行脱硫处理,其原理用方程式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离于方程式正确的是
A. 向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B. 浓盐酸与MnO2反应制取Cl2:MnO2+4HCl(浓) ![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
C. 酸性条件下,碘化钾溶液露置于空气中变质:4H++4I-+O2=2I2+2H2O
D. 向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如右下图(二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃)。实验步骤为:
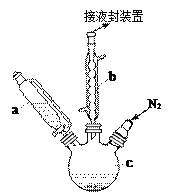

①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(密度0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25ml装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入仪器d,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是_________,作用是_________________________。
(2)步骤①中通入氮气的目的是________________________________。
(3)仪器c的适宜容积应为______:①100ml、②250ml、③500ml;仪器a使用前应进行的操作是_____,其操作过程为:关闭恒压滴液漏斗颈部旋塞_______________________。
(4)KOH、FeCl2、C5H6反应生成二茂铁[Fe(C5H5)2]和KCl的化学方程式为________________________________;步骤⑦是二茂铁粗产品的提纯,该过程在右图中进行,其操作名称为__________。
(5)为了确证得到的是二茂铁,还需要进行的一项简单实验是_____。
(6)最终得到纯净的二茂铁3.7g,则该实验的产率为_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 1mol苯乙烯中含碳碳双键数为4NA
B. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C. 标准状况下,2.24LCl2溶于水,转移6.02×1022个电子
D. 1L0.1molL-1的氨水中有0.1NA个NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在我国使用最早的合金是________,目前用量最大,用途最广泛的合金是________.
(2)0.5mol H2O 的质量为________g,共有________个原子.
(3)质量都是50g 的Cl2、NH3、CO2、O2 四种气体中,含有分子数最少的是________;在相同的温度和压强下,体积最大的是________.
(4)配制100mL 0.2mol/L CuSO4溶液,需要CuSO45H2O________g.
(5)在配制硫酸亚铁溶液时,常常加入铁粉,请说明原因________(用离子方程式表示)
(6)过氧化钠跟水反应的化学方程式是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到:
![]() +H2SO4
+H2SO4![]()
![]() +H2O
+H2O
实验室可利用如图所示装置合成对氨基苯磺酸。实验步骤如下:

①在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。
②将三颈烧瓶置于油浴中缓慢加热至170~180 ℃,维持此温度2~2.5 h。
③将反应液冷却至约50 ℃后,倒入盛有100 mL冷水的烧杯中,玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干(100 mL水在20 ℃时可溶解对氨基苯磺酸1.08 g,在100 ℃时可溶解6.67 g)。
(1)装置中冷凝管的作用是____________________。
(2)步骤②中采用油浴加热,用油浴加热的优点是____________________。
(3)步骤③用少量冷水洗涤晶体的好处是____________________。
(4)步骤③和④均进行抽滤,在抽滤后停止抽滤时,应注意先__________________,然后__________________,以防倒吸。
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是____________________________。每次抽滤后均应将母液收集并适当处理,其目的是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com