
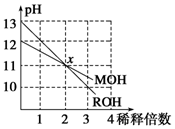
 MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )| A. | MOH和ROH都是强碱 | |
| B. | 稀释前,ROH=10MOH | |
| C. | 常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性 | |
| D. | 在x点,M+=R+ |
分析 由图可知,ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,而MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱;并根据酸碱中和及电离来解答.
解答 解:A.MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱,故A错误;
B.稀释前,c(ROH)=0.1mol/L,c(MOH)>0.01mol/L,则c(ROH)<10c(MOH),故B错误;
C.设醋酸的pH=a,ROH的pH=14-a,则醋酸和ROH溶液等体积混合时V×10-amol/L=V×1014-a-14mol/L,说明二者溶液中电离出的氢离子和氢氧根离子浓度相等,因醋酸为弱酸,不能完全电离,所以醋酸的浓度大于10-amol/L,醋酸有剩余,溶液显酸性,故C错误;
D.由ROH═R++OH-,MOH?M++OH-可知,在x点,c(OH-)相等,则c(M+)=c(R+),故D正确;
故选D.
点评 本题考查强碱、弱碱稀释及图象,明确图象中pH的变化是解答本题的关键,并注意利用pH与浓度的关系来解答,题目难度不大,侧重于考查学生的分析能力和对基本信息的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 3种溶液pH的大小顺序是③>②>① | |
| B. | 若向3种溶液都通入足量二氧化碳,pH变化最大的是② | |
| C. | 若分别加入25mL0.1mol•L-1盐酸后,pH最小的是③ | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
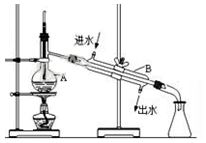
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| C(KI) | V | C(H2SO4) | V | ||||
| 1 | 25℃ | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | l组和2组探究②温度对该反应速率的影响;2组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 35℃ | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 35℃ | 1mol/L | 5mL | ①0.2mol/L硫酸 | 5mL | 3滴 | |
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/L KOH溶液,观察现象. | 若蓝色不褪色,则假设二正确. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液和Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 醋酸溶液水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | NO2与氢氧化钠的反应:3NO2+2OH-═NO3-+NO2-+2H2O | |
| D. | 向NaAlO2溶液中通入过量SO2:2AlO2-+SO2+3H2O═2A(OH)3↓+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中使用的漂白粉和肥皂都是混合物 | |
| B. | 烟、雾、豆浆、有色玻璃都是胶体 | |
| C. | 汽油属于混合物,而液氯、冰醋酸均属于纯净物 | |
| D. | 蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L NaOH溶液 | B. | 2mol/LH2SO4溶液 | C. | 2mol/LMgSO4溶液 | D. | FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
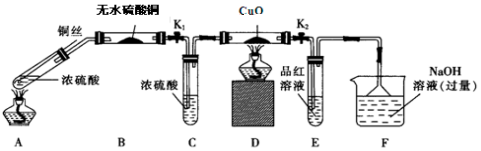
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com