
| A. | ①②③④ | B. | ①②③ | C. | ②③ | D. | ①④ |
科目:高中化学 来源: 题型:多选题
| A. | 有一澄清的碱性溶液,做离子鉴定时得出的结论是含有:Al(OH)4-、Fe3+、HCO3- | |
| B. | 某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 | |
| C. | 固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中就一定大量存在碳酸根离子 | |
| D. | 加热碳酸氢铵固体,将生成的气体通过碱石灰能制备NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:K+、SO42-、Cu2+、Cl- | |
| B. | 0.1mol/L 的FeCl2的溶液中:H+、Na+、NO3-、Cl- | |
| C. | 使甲基橙变红的溶液中:K+、HCO3-、Ba2+、I- | |
| D. | c(H+)/c(OH-)=1×10-12:NH4+、Cl-、Ca2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共有4种,其中一种物质不属于羧酸 | |
| B. | 共有5种,其中一种为二元酸 | |
| C. | 共有6种,其中只有一种不是有机酸 | |
| D. | 共有6种,它们在一定条件下均能与乙醇发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
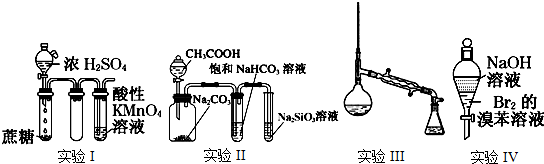
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 其他条件不变时,缩小体积,反应②平衡不移动 | |
| D. | 平衡时增大碳的质量,反应①中热量值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
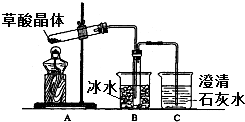 草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:
草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 食盐溶液作为电解质溶液形成原电池 | |
| C. | 银器为正极,Ag2S被还原生成单质银 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢与过氧化钠中含有化学键的类型完全相同 | |
| B. | NaHSO4在水溶液中的电离方程式为:NaHSO4═Na++H++SO42- | |
| C. | 因为NH4HCO3是强电解质,所以在其水溶液中只存在水解平衡,不存在电离平衡 | |
| D. | H216O、D216O、H218O、D218O互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com