
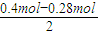 =0.06mol.令阳极气体中Cl2、O2的物质的量分别为xmol、ymol,根据转移的电子数和产生气体的物质的量列方程计算,据此判断整个电解过程中各阶段发生的反应,据此计算.
=0.06mol.令阳极气体中Cl2、O2的物质的量分别为xmol、ymol,根据转移的电子数和产生气体的物质的量列方程计算,据此判断整个电解过程中各阶段发生的反应,据此计算.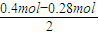 =0.06mol.
=0.06mol.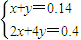 ,解得x=0.08,y=0.06,
,解得x=0.08,y=0.06,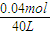 =0.001mol/L,故溶液pH=-lg
=0.001mol/L,故溶液pH=-lg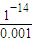 =11,
=11,

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届甘肃省张掖二中高三10月月考化学试卷(奥班)(带解析) 题型:单选题
用Pt电极电解KCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.14mol的气体,若电解后溶液体积为40L,则电解后溶液的pH为( )
| A.11 | B.5 | C.7 | D.1 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市杨家坪中学高二12月月考化学试卷(带解析) 题型:单选题
用Pt电极电解KCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.14mol的气体,若电解后溶液体积为40L,则电解后溶液的pH为( )
| A.1 | B.3 | C.7 | D.11 |
查看答案和解析>>
科目:高中化学 来源:2014届重庆市高二12月月考化学试卷(解析版) 题型:选择题
用Pt电极电解KCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.14mol的气体,若电解后溶液体积为40L,则电解后溶液的pH为( )
A.1 B.3 C.7 D.11
查看答案和解析>>
科目:高中化学 来源:2011年湖南省高二1月期末联考化学试卷 题型:选择题
用Pt电极电解KCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.14mol的气体,若电解后溶液体积为40L,则电解后溶液的pH为( )
A.1 B.3 C.7 D.11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com