
 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);分析 (1)醋酸钠溶液中醋酸根离子水解,溶液显碱性,加水稀释促进水解,平衡正向进行,氢氧化钠为强碱溶液,醋酸钠为强碱弱酸盐,加热后氢氧化钠溶液的pH基本不变,而醋酸钠的水解程度增大,溶液pH增大;
(2)从两个角度考虑,一是相同pH的(NH4)2SO4与NH4Cl溶液的水解程度是否相等,二是NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制;
(3)等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,pH=13的氢氧化钠与pH=1的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性醋酸根离子浓度大于钠离子浓度;
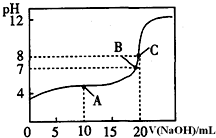
(4)由图两者恰好完全反应,溶液呈碱性,应选择碱性变色范围内的指示剂,离子浓度越大导电能力越强,根据曲线数据利用C(H+),结合HA?H++A-求出已电HA的浓度,再根据电离平衡常数表达式来解答.
解答 解:(1)pH=13的CH3COONa溶液加水稀释100倍后,由于醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11;
pH相等的NaOH溶液与CH3COONa溶液,醋酸钠为强碱弱酸盐,醋酸根离子水解溶液显示碱性,加热后醋酸根离子的水解程度增大,则溶液pH增大,所以分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH,
故答案为:>;醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11;>;
(2)相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,则溶液中铵根离子浓度大小为:①=②>③,
故答案为:①=②>③;
(3)等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,溶液中的醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,c(Na+)>c(CH3COO-),pH=13的氢氧化钠与pH=1的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性,醋酸根离子浓度大于钠离子浓度,c(Na+)<c(CH3COO-),
故答案为:碱;>;酸;<;
(4)由图两者恰好完全反应,溶液呈碱性,应选择碱性变色范围内的指示剂是酚酞,C点是离子浓度最大导电能力最强,当加氢氧化钠的体积为0时,A点时,溶液中的溶质为等浓度的NaA和HA,溶液呈酸性,所以HA的电离程度大于A-的水解程度,所以溶液中离子浓度大小的关系为c(A-)>c(Na+)>c(H+)>c(OH),故答案为:①酚酞; ②C; ③c(A-)>c(Na+)>c(H+)>c(OH).
点评 本题考查了酸碱混合反应得到溶液酸碱性的分析判断,弱电解质电离、盐类水解的原理分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 92.37% | B. | 9.2% | C. | 50% | D. | 25% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
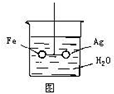 如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.
如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | W1 | W3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=1.5mol•L-1•min-1 | |
| B. | 2c1<1.5 | |
| C. | 2ρ1=ρ2 | |
| D. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}(3{c}_{1}-1.5)^{3}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加催化剂同时升高温度 | B. | 降低温度同时增大压强 | ||
| C. | 充入CO | D. | 加催化剂同时增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/°C | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com