
【题目】如图所示是实验室制取SO2并验证SO2的某些性质的装置图。试回答:
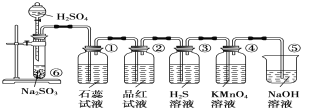
(1)①中的实验现象为石蕊试液___,此实验证明SO2是______气体。
(2)②中的品红溶液__________,证明SO2有________。
(3)③中的实验现象是____________,证明SO2有______性。
(4)④中的实验现象是____________,证明SO2有______性。
(5)⑤的作用是___________。
【答案】变红 酸性 褪色 漂白性 有淡黄色沉淀生成 氧化性 KMnO4溶液褪色 还原 吸收SO2尾气,防止污染空气
【解析】
(1)二氧化硫是酸性氧化物,与水反应生成亚硫酸,①中的实验现象时溶液变为红色,故答案为:变红;酸性;
(2)二氧化硫具有漂白性,能与品红溶液中的有色物质结合生成不稳定的无色物质,使品红溶液褪色,故答案为:褪色;漂白;
(3)SO2与H2S溶液反应的化学方程式为SO2+2H2S=3S↓+2H2O,有淡黄色沉淀生成,SO2中硫元素化合价降低,做氧化剂,故答案为:有淡黄色沉淀生成;氧化;
(4)二氧化硫有还原性,能和酸性KMnO4溶液发生氧化还原反应,使KMnO4溶液褪色,故答案为:KMnO4溶液褪色;还原;
(5)二氧化硫有毒且是空气污染物,氢氧化钠能够吸收二氧化硫,⑤装置中盛装NaOH溶液的作用是吸收SO2,防止污染空气,故答案为:吸收SO2尾气,防止污染空气。


科目:高中化学 来源: 题型:
【题目】如图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
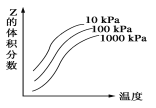
A.上述可逆反应的正反应为放热反应
B.X和Y中只有一种为气态,Z为气态
C.X、Y、Z均为气体
D.上述反应的逆反应ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a~g7种短周期元素,它们在元素周期表中的相对位置如表所示,请回答下列问题:
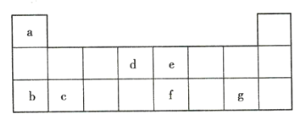
(1)下列选项中,元素的原子间最容易形成离子键的是___(填序号,下同),元素的原子间最容易形成共价键的是___。
A.c和f B.b和g C.d和g D.c和e
(2)下列由a~g7种元素原子形成的各种分子中,所有原子最外层都满足8电子稳定结构的是___(填序号)。
A.ea3 B.ag C.fg3 D.dg4
(3)由题述元素中的3种非金属元素形成的AB型离子化合物的电子式为___。
(4)c与e可形成一种化合物,试写出该化合物的化学式:___,其含有的化学键类型为___,其与过量稀盐酸反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示
分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示![]() 部分反应物、生成物没有列出
部分反应物、生成物没有列出![]() ,且A、B、C、D、E、F六种物质中均含同一种元素.
,且A、B、C、D、E、F六种物质中均含同一种元素.
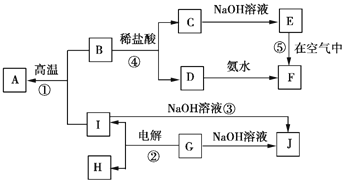
请填写下列空白:
![]() 、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为 ______ .
、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为 ______ .
![]() 反应
反应![]() 阳极的电极反应式为 ______ ,反应
阳极的电极反应式为 ______ ,反应![]() 的离子方程式为 ______ ,反应
的离子方程式为 ______ ,反应![]() 的化学方程式为 ______ .
的化学方程式为 ______ .
![]() 实验室配制C溶液时通常要加入少量的 ______ ;将少量D的浓溶液滴入沸水中得到的液体呈 ______ 色,再逐滴滴加盐酸时,产生的现象是 ______ ;
实验室配制C溶液时通常要加入少量的 ______ ;将少量D的浓溶液滴入沸水中得到的液体呈 ______ 色,再逐滴滴加盐酸时,产生的现象是 ______ ;
![]() 反应
反应![]() 中每生成3molA,转移电子的物质的量为 ______ .
中每生成3molA,转移电子的物质的量为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH +3O2→ 2CO2+3H2O,电池示意如图,下列说法正确的是
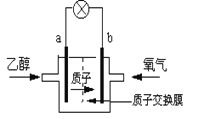
A. a极为电池的正极
B. 电池工作时电流由a极沿导线经灯泡再到b极
C. 电池负极的电极反应为:4H++ O2+ 4e-= 2H2O
D. 电池工作时,1mol乙醇被氧化时就有12mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
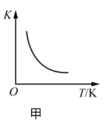
【题目】根据下列图示所得出的结论正确的是
A.图甲表示反应![]() 的平衡常数K与温度的关系,说明该反应的
的平衡常数K与温度的关系,说明该反应的![]()
B.图乙表示Cu与过量浓硝酸反应生成的![]() 气体体积随时间的变化关系,说明该反应在
气体体积随时间的变化关系,说明该反应在![]() 时间段内反应速率最快
时间段内反应速率最快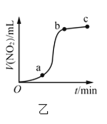
C.图丙表示一定温度下![]() 和NiS的沉淀溶解平衡曲线,说明该温度下,
和NiS的沉淀溶解平衡曲线,说明该温度下,![]() 时,两者的
时,两者的![]() 相等
相等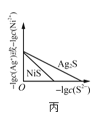
D.图丁表示相同温度下,![]() 的HF和
的HF和![]() 溶液分别加水稀释时pH的变化曲线,说明加水稀释前HF的电离程度大于
溶液分别加水稀释时pH的变化曲线,说明加水稀释前HF的电离程度大于![]() 的电离程度
的电离程度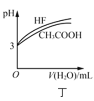
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有平衡:Br2+H2O![]() HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
B.对CO(g) + NO2 (g)![]() CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深
CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深
C.高压比常压有利于合成SO3的反应
D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 能发生的反应类型:加成反应、取代反应、消去反应、水解反应
能发生的反应类型:加成反应、取代反应、消去反应、水解反应
B.已知![]() (X)
(X)![]()
![]() (Y),X与Y互为同分异构体,可用FeCl3溶液鉴别
(Y),X与Y互为同分异构体,可用FeCl3溶液鉴别
C.3—甲基—3—乙基戊烷的一氯代物有6种
D.相同条件下乙酸乙酯在水中的溶解度比其在乙醇中的溶解度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com