
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
��1����һ�������½�CO2��H2ת��Ϊ�״�������ˮ��������ط�Ӧ�У�
CO2(g)��H2(g) ![]() CO(g)��H2O(g) ��H1����41KJ/mol
CO(g)��H2O(g) ��H1����41KJ/mol
CO(g)��2 H2(g)![]() CH3OH(g) ��H2����90KJ/mol
CH3OH(g) ��H2����90KJ/mol
���ɼ״�������ˮ����ת��ΪCO2��H2���Ȼ�ѧ����ʽΪ___________________��
��2����һ���¶��£���2L�̶��ݻ����ܱ�������ͨ��2molCO2��3molH2��������Ӧ
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H3<0��
CH3OH(g)��H2O(g) ��H3<0��
���CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
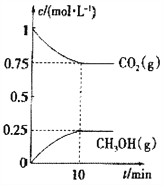
����˵���÷�Ӧ�Ѵ�ƽ��״̬����______________��
A����λʱ������3nmolH��H�����ѣ�ͬʱ����2nmolO��H������
B����������ƽ����Է�����������ʱ��仯
C�����������ܶȲ���ʱ��仯
D����ϵ��n(CO2)/n(H2)��1��1���ұ��ֲ���
�����д�ʩ��ʹn(CH3OH)/n(CO2)�������__________��
A�������¶�B�����º����£��ٳ���2molCO2��3molH2
C��ʹ�ø�Ч���� D�����º��ݳ���He(g)ʹ��ϵѹǿ����
����֪���¶��´˷�Ӧ��ƽ�ⳣ��K=0.198����ʹK��ֵ��Ϊ1��Ӧ��ȡ�Ĵ�ʩ��___________��
A�������¶� B�������¶� C������ѹǿ D����ѹ����һ����H2
��3����CO2��������Na2CO3��Һ����100mL0.1 mol/LNa2CO3��Һ��ȫ��0.44gCO2���壨��Һ������䣩��������Һ��c(HCO3��)��c(CO32��)��c(H2CO3)��__________mol/L
��4����CO2����Ȼ�������Ʊ�CO��H2��CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)���ܱ�������Ũ�Ⱦ�Ϊ0.1mol/L��CH4��CO2����һ�������·�Ӧ�����CH4 ��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ѹǿP1 ____P2���>����<��������P2=3MPa����T��Cʱ�÷�Ӧ��ƽ�ⳣ��Kp =_____MPa2����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
2CO(g)+2H2(g)���ܱ�������Ũ�Ⱦ�Ϊ0.1mol/L��CH4��CO2����һ�������·�Ӧ�����CH4 ��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ѹǿP1 ____P2���>����<��������P2=3MPa����T��Cʱ�÷�Ӧ��ƽ�ⳣ��Kp =_____MPa2����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������

���𰸡� CH3OH��g����H2O��g��![]() CO2��g����3H2��g����H��+49 kJ/mol B D B B 0.2 < 4
CO2��g����3H2��g����H��+49 kJ/mol B D B B 0.2 < 4
��������(1)����֪��Ӧ��CO2(g)��H2(g) ![]() CO(g)��H2O(g) ��H1����41KJ/mol����Ӧ�ڵ��淴ӦΪ��Ӧ��CH3OH(g)
CO(g)��H2O(g) ��H1����41KJ/mol����Ӧ�ڵ��淴ӦΪ��Ӧ��CH3OH(g) ![]() CO(g)��2 H2(g) ��H3��+90KJ/mol�����ݸ�˹���ɷ�Ӧ��-�ټ���CH3OH(g)+ H2O(g)
CO(g)��2 H2(g) ��H3��+90KJ/mol�����ݸ�˹���ɷ�Ӧ��-�ټ���CH3OH(g)+ H2O(g) ![]() CO2(g)��3H2(g) ��H��+49 kJ/mol��
CO2(g)��3H2(g) ��H��+49 kJ/mol��
(2) ���ɻ�ѧƽ��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)��֪��A����λʱ������3n mol H��H�����ѣ���3n mol H2(g)�μ��˷�Ӧ����ʾ��������������O��H�����ѱ�ʾ�������ʣ�����������1mol CH3OH(g)�к���1molO��H����1mol H2O(g)�к���2 molO��H��������Ӧ������3n molO��H����������A����ȷ��B�������������������䣬�����ʵ����ڸı䣬��M=m/n��֪����ƽ����Է�����������ʱ��仯ʱ����Ӧ�Ѵ�ƽ��״̬����B��ȷ��C�������������������䣬����������䣬����=m/V��֪���ܶ�ʼ�ղ��䣬��˵����������ܶȲ���ʱ��仯ʱ������˵����Ӧ�Ѵ�ƽ��״̬����C����D�����ڷ�Ӧ����ʼ��n(CO2)��n(H2)��ϵ�����ɱ��������Ե�n(CO2)/n(H2)��1��1�ұ��ֲ���ʱ��˵����Ӧ�Ѵ�ƽ��״̬����D��ȷ������ȷ��ΪBD��
CH3OH(g)��H2O(g)��֪��A����λʱ������3n mol H��H�����ѣ���3n mol H2(g)�μ��˷�Ӧ����ʾ��������������O��H�����ѱ�ʾ�������ʣ�����������1mol CH3OH(g)�к���1molO��H����1mol H2O(g)�к���2 molO��H��������Ӧ������3n molO��H����������A����ȷ��B�������������������䣬�����ʵ����ڸı䣬��M=m/n��֪����ƽ����Է�����������ʱ��仯ʱ����Ӧ�Ѵ�ƽ��״̬����B��ȷ��C�������������������䣬����������䣬����=m/V��֪���ܶ�ʼ�ղ��䣬��˵����������ܶȲ���ʱ��仯ʱ������˵����Ӧ�Ѵ�ƽ��״̬����C����D�����ڷ�Ӧ����ʼ��n(CO2)��n(H2)��ϵ�����ɱ��������Ե�n(CO2)/n(H2)��1��1�ұ��ֲ���ʱ��˵����Ӧ�Ѵ�ƽ��״̬����D��ȷ������ȷ��ΪBD��
������CO2(g)�Ƿ�Ӧ�CH3OH(g)����������Ը�ƽ���������ƶ�����ʹn(CH3OH)/n(CO2)������֪�÷�Ӧ�����������С�ķ��ȷ�Ӧ����A�������¶ȣ���ƽ���������ƶ�����A����B�����º����£��ٳ���2mol CO2��3mol H2���൱�ڼ�ѹ����ƽ�������ƶ�����B��ȷ��C��ʹ�ô���ֻ�Ǽӿ��˷�Ӧ���ʣ���ƽ�ⲻ�ƶ�����C����D�����º��ݳ���He(g)��������ʹ��ѹǿ����������Ӧ��ϵ�ķ�ѹ���䣬����Ӧ������Ũ�ȶ����䣬����ƽ�ⲻ�ƶ�����D�����������ȷ��ΪB��
����֪�÷�Ӧ�Ƿ��ȷ�Ӧ����ƽ�ⳣ��Kֻ���¶ȵı仯���ı䣬Ҫʹƽ�ⳣ��Kֵ������ƽ�������ƶ������Բ�ȡ�Ĵ�ʩ���ǽ����¶�������ȷ��ΪB��
(3)��֪Na2CO3��CO2��Ӧ�ķ���ʽΪNa2CO3��CO2��H2O![]() 2NaHCO3��n(Na2CO3)= 0.10 L��0.1 mol/L=0.01 mol��n(CO2)=
2NaHCO3��n(Na2CO3)= 0.10 L��0.1 mol/L=0.01 mol��n(CO2)=![]() ����˶���ǡ����ȫ��Ӧ����0.02mol��NaHCO3������HCO3������ˮ������H2CO3�����ܵ�������CO32�������������غ�ɵã���Һ��c(HCO3��)��c(CO32��)��c(H2CO3)��0.02mol/0.1L=0.2 mol/L��
����˶���ǡ����ȫ��Ӧ����0.02mol��NaHCO3������HCO3������ˮ������H2CO3�����ܵ�������CO32�������������غ�ɵã���Һ��c(HCO3��)��c(CO32��)��c(H2CO3)��0.02mol/0.1L=0.2 mol/L��
(4)��ͼ���֪CH4 ��ƽ��ת�������¶����߶�������ѹǿΪP1ʱCH4 ��ƽ��ת���ʱ仯������ѹǿP2ʱ��CH4 ��ƽ��ת���ʱ仯����������ͬ�¶��£���P2ת��P1ʱ��CH4 ��ƽ��ת��������˵��ƽ�������ƶ�������һ�������������ķ�Ӧ�����Сѹǿ��ƽ�������ƶ�������P1< P2�������������Ϊ1L����ͼ���֪��ƽ��ʱn(CH4)=n(CO2) =0.1mol/L��1L��(1-50%)=0.05 mol��n(H2)=n(CO)=0.1mol L��1L��50%��2=0.1 mol������p(CH4)= p(CO2)=P2��![]() = 0.5 MPa��p(H2)= p(CO)=P2��
= 0.5 MPa��p(H2)= p(CO)=P2��![]() = 1.0 MPa������Kp=
= 1.0 MPa������Kp=![]() =
=![]() = 4 (Mpa)2��
= 4 (Mpa)2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���������ԭ�Ӷ����������8���ӽṹ����(�� )
A. NCl3 B. PCl5
C. CH3Cl D. BF3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����a | ��̿���ڸ��������»�ԭCuO |
����b | ��ⷨ����ӦΪ2Cu + H2O |
����c | ���£�N2H4����ԭ����Cu(OH)2 |
��1����֪��2Cu(s)��![]() O2(g)=Cu2O(s)��H =-169kJ��mol-1
O2(g)=Cu2O(s)��H =-169kJ��mol-1
C(s)��![]() O2(g)=CO(g)��H =-110.5kJ��mol-1
O2(g)=CO(g)��H =-110.5kJ��mol-1
Cu(s)��![]() O2(g)=CuO(s)��H =-157kJ��mol-1
O2(g)=CuO(s)��H =-157kJ��mol-1
��a������Ӧ���Ȼ�ѧ����ʽ��_____________________________________��
��2������b�������ӽ���Ĥ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ�������ӽ���ĤΪ______���ӽ���Ĥ(�����������),�õ�ص�������ӦʽΪ______________________________________��

��3������cΪ������������Һ̬�£�N2H4����ԭ����Cu(OH)2���Ʊ�����Cu2O��ͬʱ�ų�N2�����Ʒ��Ļ�ѧ����ʽΪ________________________________________��
��4�����ݻ�Ϊ1L�ĺ����ܱ������У������Ϸ����Ƶõ���������Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺2H2O(g) ![]() 2H2(g)+O2(g)����H>0��ˮ������Ũ��c��ʱ��t�ı仯���±���ʾ��
2H2(g)+O2(g)����H>0��ˮ������Ũ��c��ʱ��t�ı仯���±���ʾ��

�ٶԱ�ʵ����¶ȣ�T2_________T1�����������������=����
�ڴ�����Ч�ʣ�ʵ���________ʵ��ڣ������������
����ʵ��۴ﵽƽ��״̬�����������ͨ��ˮ������������0.1mol����Ӧ�ٴδﵽƽ��ʱ��������������Ũ��Ϊ ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A~J����ѧ��ѧ���������ʣ�����֮���ת����ϵ����ͼ��ʾ �����ַ�Ӧ��������������ʡ�ԣ�����֪A��һ�ָ��۵����ʣ�D��һ�ֺ���ɫ���塣
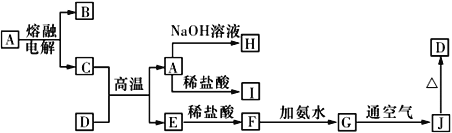
��ش��������⣺
��1�����A���ʵ������缫��ӦʽΪ________��C��D�ڸ����·�Ӧ�������÷�Ӧ��Ҫ����������Լ���________________________�������ƣ���
��2��д��G��J��Ӧ��ʵ�������뻯ѧ����ʽ��____________________________��________________________________��
��3��C��NaOH��Һ��Ӧ�����ӷ���ʽΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��4molL��1��KOH��Һ100mL��ȡ��5mL����5mL��Һ��K+Ũ��Ϊ�� ��
A.4 molL��1
B.0.2molL��1
C.2 molL��1
D.0.4 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)������������HNO2��Ӧ�õ����ǻ��ᡣ�磺

��д�����б仯��A��B��C��D�����л���Ľṹ��ʽ��
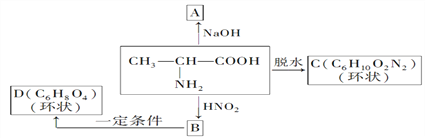
A______��B______��C______��D______��
(2)���������У�������NaOH��Ӧ�����������ᷴӦ������ˮ�����________(��ѡ���)��
��Al2O3����Al(OH)3���۰����ᡡ�ܶ��ġ�
��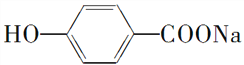 ����(NH4)2CO3
����(NH4)2CO3
��NaHCO3������ά�ء��ᵰ���ʡ���NH4I
A���٢ڢۢ� B���ܢݢޢߢ��
C���ۢܢݢޢ�� D��ȫ��
(3)�����йص����ʵ���������ȷ����________��
�ٵ�������Һ����뱥���������Һ���г����������ټ���ˮ��Ҳ���ܽ⣻
���¶�Խ�ߣ�ø���Ļ�ѧ��ӦԽ�죻
����Ȼ�����ʵ�ˮ�����ղ��X����Ϊ�������
���ؽ�������ʹ�����ʱ��ԣ�������ʳ�ؽ����λ��ж���
�ݰ�����͵����ʾ��Ǽ�����ǿ�ᷴӦ������ǿ�Ӧ���������ʣ�
��ͨ���þƾ���������Ϊ�ƾ���ʹϸ���еĵ����ʱ��Զ�ʧȥ�������ԣ�
����֯���Dz�˿��������˿��������������ζ�ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ��Ӧ2KBr+Cl2=2KCl+Br2�У��������ǣ� ��
A.KBrB.Cl2C.KClD.Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л����������г��ȼ�գ����ɵ����ʵ�����ˮ�Ͷ�����̼������л����������������ǣ�������
A. �����е�C��H��O�ĸ�����Ϊ1��2��3B. ������C��H������Ϊ1��2
C. ���л������Է�������Ϊ14D. �÷����п϶�������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ļ�����������������������Ҫ����;��
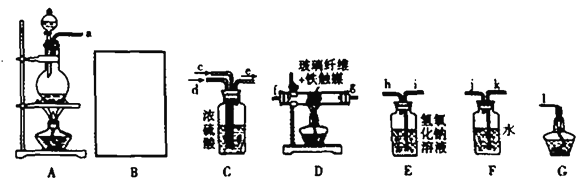
��.ij��ѧ��ȤС����������װ��ģ��ϳɰ����Ʊ�������ˮ
��֪������(85��) NH4Cl��NaNO2������Һ������ȡN2.
��1����B������ȡ����(���õ�ҩƷ��п����ϡ����)Ҫ�������濪���ã������ͣ��������ѡȡ����______װ�á�
Ϊ�����ʵ��,װ�ô����ҽӿڵ�����˳����(װ�ò����ظ�ʹ��):_______________
![]()
��2��D�в�����ά�������ǣ�__________��
��3��С���м�ͬѧ��ΪFװ�ò�̫����,ʵ���л������������ͬѧ�����������Ϊ��װ������Ľ�,����������:___________��
��.��ͨ������´���2NO2(g)![]() N2O4(g)�ķ�Ӧ��������,��һ����NO2��N2O4(g)�Ļ����������ݻ��̶���2L�ܱ������У����и��������ʵ���Ũ����ʱ��仯��ϵ��ͼ��ʾ��
N2O4(g)�ķ�Ӧ��������,��һ����NO2��N2O4(g)�Ļ����������ݻ��̶���2L�ܱ������У����и��������ʵ���Ũ����ʱ��仯��ϵ��ͼ��ʾ��
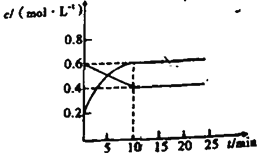
��4����Ӧ2NO2(g)![]() N2O4(g)���ر� ��S____0���ʱ���H_____0(����>������<��������=��)��
N2O4(g)���ر� ��S____0���ʱ���H_____0(����>������<��������=��)��
��5������Ϊ�ж��������淴Ӧ�ﵽƽ��״̬�����ݵ���______
A.2v(N2O4)=v(NO2)
B.������ѹǿ����
C.������������ܶȲ���
D.������NO2�������������
E.�������������ɫ����
��6��ǰ10min��,��v(NO2)��ʾ�ķ�Ӧ����Ϊ____mol��L-1��min-1.
��7���������´ﵽƽ��״̬ʱ����������ѹǿ����ʼʱѹǿ��____��.
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com