
 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:分析 前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素;X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分,为乙醇,则X、Y、E分别是H、C、O元素,Z原子序数大于Y而小于E,则Z为N元素;
取F的化合物做焰色反应实验,其焰色呈黄色,则F为Na元素;
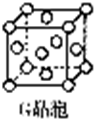
G的单质是生活中常见的一种金属,GE是黑色固体,G2E是红色固体,则G为Cu元素;
(1)G为Cu元素,其原子核外有29个电子,根据价层电子对互斥理论书写其基态原子核外电子排布式;
同一周期元素其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,元素的金属性越强,其第一电离能越小;
(2)X、Y、Z形成3原子分子M,每个原子价层电子均达到稳定结构,则为HCN,H原子形成1个共价键、C原子形成4个共价键、N原子形成3个共价键;该分子中含有2个π键;
(3)NO2-中中心原子价层电子对个数=2+$\frac{5+1-2×2}{2}$=3且含有1个孤电子对,CO32-中C原子价层电子对个数=3+$\frac{4+2-3×2}{2}$=0且不含孤电子对,根据价层电子对互斥理论判断空间构型和杂化方式;
(4)Y、E、Z分别与X形成的简单化合物分别是甲烷、水、氨气,分子晶体熔沸点与相对分子质量成正比,且含有氢键的氢化物熔沸点较高;
(5)该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据ρ=$\frac{\frac{M}{{N}_{A}}×4}{V}$计算阿伏伽德罗常数.
解答 解:周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素;X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分,为乙醇,则X、Y、E分别是H、C、O元素,Z原子序数大于Y而小于E,则Z为N元素;
取F的化合物做焰色反应实验,其焰色呈黄色,则F为Na元素;
G的单质是生活中常见的一种金属,GE是黑色固体,G2E是红色固体,则G为Cu元素;
(1)G为Cu元素,其原子核外有29个电子,根据价层电子对互斥理论书写其基态原子核外电子排布式为1s22s22p63s23p63d104s1 或[Ar]3d104s1;
同一周期元素其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,元素的金属性越强,其第一电离能越小,其第一电离能从小到大顺序是Na<Cu<C<O<N,
故答案为:1s22s22p63s23p63d104s1 或[Ar]3d104s1;Na<Cu<C<O<N;
(2)X、Y、Z形成3原子分子M,每个原子价层电子均达到稳定结构,则为HCN,H原子形成1个共价键、C原子形成4个共价键、N原子形成3个共价键,其结构式为H-C≡N;该分子中含有2个π键,所以1molM含π键数目为 2×6.02×1023或2NA,故答案为:H-C≡N; 2×6.02×1023或2NA;
(3)NO2-中中心原子价层电子对个数=2+$\frac{5+1-2×2}{2}$=3且含有1个孤电子对,根据价层电子对互斥理论知,该微粒空间构型为V形,CO32-中C原子价层电子对个数=3+$\frac{4+2-3×2}{2}$=0且不含孤电子对,该微粒中C原子杂化方式为sp2,
故答案为:V形;sp2;
(4)Y、E、Z分别与X形成的简单化合物分别是甲烷、水、氨气,分子晶体熔沸点与相对分子质量成正比,且含有氢键的氢化物熔沸点较高,甲烷中没有氢键而氨气和水中都含有氢键,且常温下水为液态,所以熔沸点高低顺序是H2O、NH3、CH4,故答案为:H2O、NH3、CH4;
(5)该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据ρ=$\frac{\frac{M}{{N}_{A}}×4}{V}$知,NA=$\frac{4M}{ρV}$=$\frac{64×4}{{a}^{3}×1{0}^{-30}×b}$mol-1=$\frac{256×1{0}^{30}}{{a}^{3}b}$mol-1,故答案为:$\frac{256×1{0}^{30}}{{a}^{3}b}$.
点评 本题考查物质结构和性质,涉及晶胞计算、氢键、微粒空间构型判断、原子杂化方式判断等知识点,明确基本理论基本原理是解本题关键,侧重考查学生对基本知识的灵活运用,难点是晶胞计算.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )| A. | ①加CCl4 ②加苯 ③加酒精 | B. | ①加酒精 ②加CCl4 ③加苯 | ||
| C. | ①加苯 ②加CCl4 ③加酒精 | D. | ①加苯 ②加酒精 ③加CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取滤渣加入稀氨水中,不能溶解 | |
| B. | 取滤渣加入NaOH溶液中,能溶解 | |
| C. | 取滤渣加入稀盐酸中,能溶解 | |
| D. | 将滤渣平分成两等份,分别加入NaOH溶液和稀盐酸中,均能溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O晶体和NH4Cl混合搅拌 | B. | 硫酸与氢氧化钠反应 | ||
| C. | 锌和盐酸反应 | D. | 氢气和氧气的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥ | D. | ①②③④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com