
| 选项 | A | B | C | D |
| n(CO2)(mol) | 1 | 2 | 4 | 5 |
| n(沉淀)(mol) | 0 | 1 | 3 | 3 |
| A. | A | B. | B | C. | C | D. | D |
分析 CO2通入到NaOH、Ba(OH)2、NaAlO2的混合溶液,反应的先后顺序为:Ba(OH)2、NaOH、NaAlO2,则混合溶液中慢慢通入CO2,发生的反应有:CO2+Ba(OH)2=BaCO3↓+H2O、2NaOH+CO2=Na2CO3+H3O、2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3;若二氧化碳过量,还发生Na2CO3+CO2+H2O=2NaHCO3 、BaCO3+CO2+H2O=Ba(HCO3)2,根据反应的方程式计算.
解答 解:A.通入1mol二氧化碳,先发生Ba(OH)2+CO2=BaCO3↓+H2O,消耗1mol二氧化碳,生成1mol碳酸钡沉淀,则沉淀有1mol,故A错误;
B.通入2mol二氧化碳,先发生Ba(OH)2+CO2=BaCO3↓+H2O,消耗1mol二氧化碳,生成1mol碳酸钡沉淀,剩余的1mol二氧化碳与2mol氢氧化钠反应恰好反应,CO2+2NaOH=Na2CO3+H2O,则沉淀只有1mol,故B正确;
C.通入4mol二氧化碳,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,消耗1mol二氧化碳,生成1mol碳酸钡沉淀,剩余3mol二氧化碳与氢氧化钠发生反应:CO2+NaOH=NaHCO3,消耗二氧化碳2mol,最后1mol二氧化碳与NaAlO2发生反应2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3,生成2mol氢氧化铝沉淀,故生成沉淀总物质的量为3mol,故C正确;
D.当通入5mol二氧化碳,分别发生反应Ba(OH)2+CO2=BaCO3↓+H2O、CO2+NaOH=NaHCO3、2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3,生成1mol碳酸钡、2mol氢氧化铝沉淀,2mol碳酸氢钠,1mol碳酸钠,消耗4mol二氧化碳,剩余的1mol二氧化碳与生成的1mol碳酸钠反应:Na2CO3+CO2+H2O=2NaHCO3,所以生成沉淀的物质的量为3mol,故D正确;
故选A.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及反应的先后顺序为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2.0 L 1.0 mol•L-1CH3COOH溶液中的H+数 | |
| B. | 2.0 L 1.0 mol•L-1 CH3COONa溶液中的CH3COO-数 | |
| C. | 1.0 L 1.0 mol•L-1 NaHCO3 溶液中的HCO3-数 | |
| D. | 1.0 L 1.0 mol•L-1 Na2CO3溶液中的CO32-数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
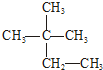 ③C60 ④氯气 ⑤
③C60 ④氯气 ⑤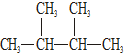 ⑥液氯 ⑦石墨 ⑧${\;}_{17}^{35}$Cl.
⑥液氯 ⑦石墨 ⑧${\;}_{17}^{35}$Cl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.5 mL | B. | 15.0 mL | C. | 17.5 mL | D. | 35.0 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com