
| A、将CuCl2溶液置于表面皿中加热蒸干,可制取无水CuCl2固体 |
| B、将NH4HCO3饱和溶液置于蒸发皿中加热蒸干,可制取NH4HCO3固体 |
| C、向FeCl3饱和溶液缓慢滴入过量氨水加热,可制取Fe(OH)3胶体 |
| D、用铜和浓硝酸制备NO2 |


科目:高中化学 来源: 题型:
| A、加入铜粉,v(H2)增大 |
| B、加入NaCl固体,会增大Cl-浓度,从而使v(H2)增大 |
| C、加入NaHSO4固体v(H2)不变 |
| D、加入水,锌不与水反应,v(H2)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甲基的电子式: | ||
B、乙烯的比例模型: | ||
C、质子数为53,中子数为78的碘原子:
| ||
| D、次氯酸的结构式:H─O─Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
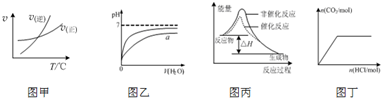
| A、由图甲表示的反应速率随温度变化的关系可知该反应的△H>0 |
| B、图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸 |
| C、图丙表示该反应为放热反应,且催化剂能改变反应的焓变 |
| D、图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )
质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )| A、溶液中H+透过质子交换膜从右向左迁移 |
| B、b极发生氧化反应 |
| C、电子从a极流出经溶液流到b极 |
| D、该电池在使用过程中,H+的物质的量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
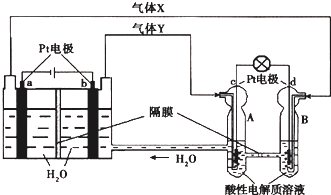
| A、当有0.1mol电子转移时,a极产生0.56L O2(标准状况下) |
| B、为了增加导电性可以将左边容器中的水改为食盐水 |
| C、c极上进行还原反应,B中的H+可以通过隔膜进入A |
| D、d极上发生的电极反应是:O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 | ||
| B、人造纤维可利用竹子、棉花、麻类的纤维材料制成,而合成纤维是利用自然界的非纤维材料(如石油、煤)通过化学合成方法得到 | ||
| C、有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是: CH3C≡CH+CO+CH3OH
 ,其过程符合绿色化学的原则 ,其过程符合绿色化学的原则 | ||
| D、温室效应导致海水的酸度增加,珊瑚、贝壳类等生物的生存将会受到威胁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| B、28g乙烯所含共用电子对数目为4NA |
| C、1mol甲基的电子数目为7NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥ | B、③④⑤⑥ |
| C、②④⑤⑥ | D、①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com