

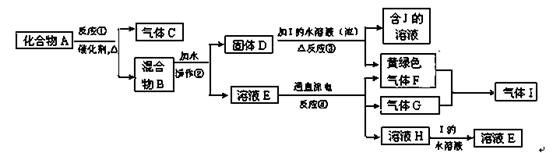
 2KCl+3O2↑ MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O ;(4)饱和食盐水,浓H2SO4。
2KCl+3O2↑ MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O ;(4)饱和食盐水,浓H2SO4。 2KCl+3O2↑,A为KClO3、MnO2的混合物,气体C为O2:(1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选B用向上排空气法收集;(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯,为得到固体D,应利用洗涤除去附着在MnO2表面的K+、Cl-等离子,然后再干燥,故答案为:过滤;漏斗、玻璃棒、烧杯;(3)反应①的化学方程式为2KClO3
2KCl+3O2↑,A为KClO3、MnO2的混合物,气体C为O2:(1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选B用向上排空气法收集;(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯,为得到固体D,应利用洗涤除去附着在MnO2表面的K+、Cl-等离子,然后再干燥,故答案为:过滤;漏斗、玻璃棒、烧杯;(3)反应①的化学方程式为2KClO3 2KCl+3O2↑,反应④的离子反应为MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,故答案为:饱和食盐水,浓H2SO4。
2KCl+3O2↑,反应④的离子反应为MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,故答案为:饱和食盐水,浓H2SO4。

科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少许反应后溶液于试管中,滴加 | 若 ,则假设 成立。 |
| 步骤:2:另取少许反应后溶液于试管中,滴加 | 若 ,则假设 成立。 若 , 则假设3成立。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
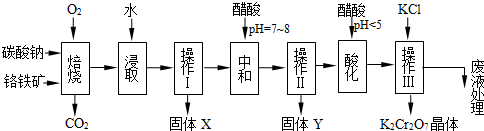
 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑; 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
 ), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X中一定不存在FeO | B.不溶物Y中一定含有Fe和CuO |
| C.Z溶液中一定含有KCl、K2CO3 | D.Y中不一定存在MnO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 E.蒸发结晶 F.高温分解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
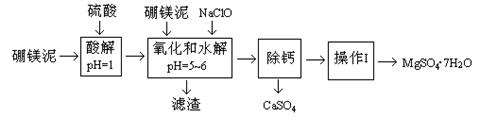
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
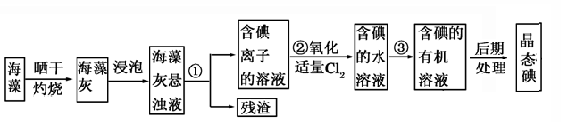
| A.甲苯、酒精 | B.四氯化碳、苯 | C.汽油、乙酸 | D.汽油、甘油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com