
加热N2O5,依次发生的分解反应为:①N2O5(g) N2O3(g)+O2(g), ②N2O3(g)
N2O3(g)+O2(g), ②N2O3(g) N2O(g)+O2(g).在容积为2L的密闭容器中充入8molN2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为
N2O(g)+O2(g).在容积为2L的密闭容器中充入8molN2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为
A.10.7 B.8.5 C.9.6 D.10.2
科目:高中化学 来源:2014-2015浙江省高二1月月考化学试卷(解析版) 题型:填空题
(16分)根据题给信息,完成下列各小题:
Ⅰ、某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c(Na+)=4×10—4mol/L,c(SO42—)=2.5×10—4mol/L,c(Cl—)=1.6×10—5 mol/L,c(NO3—)=1.4×10—5 mol/L,c(Ca2+)=1.5×10—5 mol/L,则该废水的pH为________。
Ⅱ、有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大;NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则这四种酸的酸性由强到弱的顺序为______________________。
Ⅲ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得
溶液的pH如下表:
实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸__________(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=__________mol·L-1。
(3)②组情况表明,c__________0.2 mol/L(选填“大于”、“小于”或“等于”)。
混合液中离子浓度c(A-)与c(Na+)的大小关系是___________。
(4)从③组实验结果分析,说明HA的电离程度__________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:选择题
某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:选择题
对可逆反应4NH3(g) + 5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期中考试化学试卷(解析版) 题型:填空题
(12分)苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH= CH2)的反应方程式为:
C6H5-CH2CH3 (g) C6H5-CH=CH2 (g) +H2(g) ΔH1=+125kJ?mol﹣1
C6H5-CH=CH2 (g) +H2(g) ΔH1=+125kJ?mol﹣1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:

600℃时,由上图可知:
①氢气的物质的量分数为 。
②此温度下该反应的平衡常数 。
(2)分析上述平衡体系组成与温度的关系图:
当温度高于970℃,苯乙烯的产率不再增加,其原因可能是 。
(3)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。

加入稀释剂能影响C6H5C2H5平衡转化率的原因是:______________________________。
(4)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因______________________________________________。
(5)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%
(6)乙苯在特定催化剂下发生氧化脱氢:
C6H5-CH2CH3 (g)+ 1/2O2(g) C6H5-CH=CH2 (g) +H2 O (g) ΔH
C6H5-CH=CH2 (g) +H2 O (g) ΔH
已知 H2的燃烧热ΔH为-285.8KJ/mol,水的汽化热为2441.12焦耳/克,则 ΔH= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期中考试化学试卷(解析版) 题型:选择题
用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A.碱式滴定管未用待测液润洗
B.滴定过程中不慎有液体溅出
C.滴定前仰视读数,滴定后读数正确
D.酸式滴定管未用标准盐酸润洗
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期中考试化学试卷(解析版) 题型:选择题
已知水的电离平衡曲线如图所示,下列说法正确的是

A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
C.向水中加入醋酸钠固体,可从C点到D点
D.升高温度可实现由C点到D点
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省赣州市北校区高二1月月考化学试卷(解析版) 题型:选择题
恒温恒容条件下,进行以下反应:H2(g)+ Br2(g) 2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
A.达平衡时HBr物质的量一定仍为a mol
B.两平衡压强比为3:(x+y+z)
C.达平衡时HBr的物质的量为(x+y+z)a/3
D.x、y、z应满足的关系是 4x+z= 2y
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二12月月考化学(选修)试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH- → CH3COOH+ C2H5O-
B.用银氨溶液检验乙醛的醛基:CH3CHO +2Ag(NH3)2+ + 2OH- 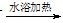 CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O
CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O
C.向苯酚钠溶液中通入少量的CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2CO32-
2C6H5OH + 2CO32-
D.甘氨酸与氢氧化钠溶液反应: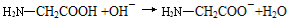
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com