
铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
【知识点】铜及其化合物的性质C3 B3
【答案解析】 (1)S 1.2NA
(2)2Cu2++4H++O2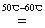 2Cu2++2H2O
2Cu2++2H2O
2Cu2++2Cl-+SO32-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
(3)①CuO+SO2↑+H2O ②ac
解析:(1)Cu2S+O2 2Cu+SO2反应制取粗铜,硫元素的化合价从-2升到+4,被氧化,反应中被氧化的元素是S,当消耗32 g Cu2S时,转移电子数目是
2Cu+SO2反应制取粗铜,硫元素的化合价从-2升到+4,被氧化,反应中被氧化的元素是S,当消耗32 g Cu2S时,转移电子数目是 。
。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:2Cu2++4H++O2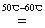 2Cu2++2H2O。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,离子方程式:2Cu2++2Cl-+SO32-+H2O
2Cu2++2H2O。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,离子方程式:2Cu2++2Cl-+SO32-+H2O 2CuCl↓+SO42-+2H+。
2CuCl↓+SO42-+2H+。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①按照甲同学猜想:铜被氧化得CuO,硫酸还原为SO2,化学方程式表示为:
Cu+H2SO4 CuO+SO2↑+H2O,
CuO+SO2↑+H2O,
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,分析可能的理由时,应该从反应现象和氧化还原反应原理入手,ac符合。
【思路点拨】本题考查了铜及其化合物的性质,注意题目的引导,结合所学知识、原理即可解答。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列与实验相关的叙述正确的是_______________。
A.用石墨电极电解足量NaCl溶液一段时间,要恢复到原溶液,应加入一定量的稀盐酸
B. 可用重结晶法提纯含少量NaCl的KNO3晶体
C.浓硫酸不小心沾到皮肤上,立即用稀NaOH溶液洗涤
D.测定某溶液的pH时,在湿润的pH试纸上滴加待测溶液,一段时间后,与标准比色卡对比
E.蛋白质溶液中加入硫酸铜溶液,会有沉淀析出,该沉淀不能再溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为:2Zn+O2===2ZnO,原料为锌粒、电解液和空气。则下列叙述正确的是(双选)( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-===Zn2+
C.正极发生氧化反应
D.电解液肯定不是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
①反应C+G B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
⑴ ①中反应的化学方程式为
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉 克
(3) C与过量NaOH溶液反应的离子方程式为 ,
反应后的溶液与过量的化合物I反应的离子方程式为
(4) E与I反应的化学方程式为
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol

查看答案和解析>>
科目:高中化学 来源: 题型:
对某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色无味的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO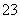
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO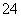
C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH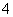
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积0.224L(以标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
A.Cl2通入FeSO4溶液中 B.CO2通入Ca(OH)2溶液中
C.将AlCl3溶液滴入 NaOH 溶液中 D.SO2通入BaCl2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质用途的说法中,正确的是( )
A.玻璃容器可长期盛放各种酸 B.硝酸常用作金属铜加工前的酸洗
C.碳酸钠可用于治疗胃酸过多 D.三氧化二铁常用于生产红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是:
(CH3)2C O+HCN
O+HCN (CH3)2C(OH)CN
(CH3)2C(OH)CN
(CH3)2(OH)CN+CH3OH+H2SO4
CH2 C(CH3)COOCH3+NH4HSO4
C(CH3)COOCH3+NH4HSO4
90年代新法的反应是:
CH3C≡CH+CH3OH+CO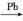 CH2
CH2 C(CH3)COOCH3
C(CH3)COOCH3
与旧法比较,新法的优点是(CD)
A. 原料无爆炸危险
B. 原料都是无毒物质
C. 没有副产物,原料利用率高
D. 对设备腐蚀较小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com