
���� ��1����һ���̶�������ܱ���������������壬��Ӧ��������Ũ�Ȳ��䣬��ƽ�ⲻ�ƶ���
��2����C��ʾ2������ƽ����Ӧ��������֮�ȵ��ڶ�Ӧ���ʵĻ�ѧ������֮�ȣ���Ӧ�Ľ���Ũ���ڼ�С��Ũ��ԽС����Խ����
��3���¶����ߣ�ƽ��ʱ��������ƽ����Է���������С��˵���¶�����ƽ����ѧ���������ӵķ����ƶ���
��4������B��ת���ʣ�Ҳ�����ڲ�����B�Ļ�����ƽ�������ƣ�
��5������ɱ䣬ά������ѹǿ���¶Ȳ��䣬��ͬ;���ﵽƽ���C��Ũ����Ϊ1.2mol/L��˵����ԭƽ��Ϊ��Чƽ�⣬����ѧ������ת������ߣ�����n��A����n��B��=2��1���ɣ��ݴ˽��
��� �⣺��1����һ���̶�������ܱ���������������壬��Ӧ��������Ũ�Ȳ��䣬��ƽ�ⲻ�ƶ����ʴ�Ϊ������
��2����A��ʾ2������ƽ����Ӧ��������Ϊ��$\frac{1.2mol/L}{2min}$=0.6 mol/��L•min��������֮�ȵ��ڶ�Ӧ���ʵĻ�ѧ������֮�ȣ�����$\frac{V��A��}{V��C��}$=$\frac{2}{3}$������V��A��=0.4 mol/��L•min������Ӧ�Ľ���Ũ���ڼ�С��Ũ��ԽС����Խ�����ʴ�Ϊ��0.4 mol/��L•min��������
��3���¶����ߣ�ƽ��ʱ��������ƽ����Է���������С��˵���¶�����ƽ����ѧ���������ӵķ����ƶ�����ƽ�������ƶ�������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
��4���ټ���A��ƽ�������ƶ���B��ת��������ѡ��
�ڼ���B��ƽ�������ƶ���B��ת���ʼ�С���ʲ�ѡ��
�ۼ�ѹ��ƽ�������ƶ���B��ת���ʼ�С���ʲ�ѡ��
���ټ���1.6mol A+0.8mol B���൱������ѹǿ��ƽ�������ƶ���B��ת���ʼ�С���ʲ�ѡ��
�ݽ�C�����������ƽ�������ƶ���B��ת��������ѡ��
�ʴ�Ϊ���٢ݣ�
��5����4molA+2mol B������n��A����n��B��=2��1�ﵽƽ��ʱC��Ũ����Ϊ1.2mol/L����ѡ��
��3molC+1molD+lmolB������ѧ������ת������ߣ�������n��A����n��B��=2��1���ʲ�ѡ��
��3molC+2mol D������ѧ������ת������ߣ�������n��A����n��B��=2��1���ʲ�ѡ��
��1.6molA+0.8molB+0.6molC+0.2molD������n��A����n��B��=2��1����ѡ��
�ʴ�Ϊ���٢ܣ�
���� ���⿼�黯ѧƽ���Ӱ�����أ���ѧ��Ӧ���ʵ����֪ʶ���͵�Чƽ���Ӧ�ã��Ѷ��еȣ�


 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��ԭ�ӹ�������ֻ������2�����ӣ�������������ͬ | |
| B�� | ��һ�ܲ���ܼ����Ǵ�s�ܼ���ʼ����f�ܼ���β�������ܼ������ڸ��ܲ����� | |
| C�� | ͬ��s�ܼ����ڲ�ͬ���ܲ����������ɵ����������Dz���ͬ�� | |
| D�� | ��ԭ�Ӻ����11���˶���ʽ��ͬ�ĺ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ÿ����55 g K2Sת�Ƶ�����Ϊ6.02��1023 | |
| B�� | S��KNO3��Ϊ��ԭ�� | |
| C�� | ��Ӧ�����е�Ԫ�ر���ԭ | |
| D�� | CO2Ϊ��ԭ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaCO3$\frac{\underline{\;����\;}}{\;}$CaO+CO2�� | B�� | 2HI$\frac{\underline{\;����\;}}{\;}$H2+I2 | ||
| C�� | H2O+SO2�TH2SO3 | D�� | Fe2O2+3CO$\frac{\underline{\;����\;}}{\;}$2Fe+3CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��Ӧ����ܼ��ܸ�����������ܼ��� | |
| B�� | ����a��ʹ���˴����������仯���� | |
| C�� | �Ȼ�ѧ����ʽΪ��CO��g��+2H2��g��?CH3OH��g����H=-91kJ•mol-1 | |
| D�� | CO��g��+2H2��g��?CH3OH��1����g����H��-91kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
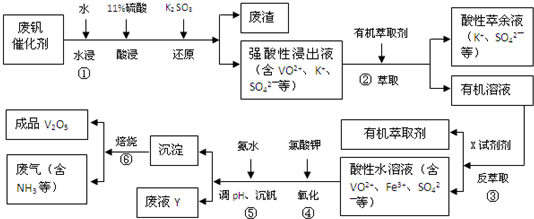
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| ��������/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
�鿴�𰸺ͽ���>>
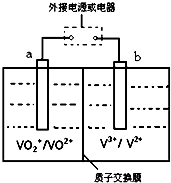
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com