
【题目】某一反应在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为( )
A. 大于25.3% B. 小于25.3% C. 等于25.3% D. 约等于25.3%
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】某温度下,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=1.该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示.下列判断不正确的是( )
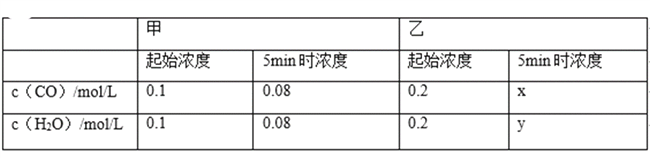
A. x=y=0.16
B. 反应开始时,乙中反应速率比甲快
C. 甲中0~5min的平均反应速率:v(CO)=0.004 mol/(Lmin)
D. 平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol CH4的质量为________g,约含有______个H,在标准状况下的体积为_______L。
(2)相同质量的CO和CO2,它们所含的原子数之比为_______,在同温同压下,它们的密度之比为______;等物质的量的CO和CO2的混合气体的密度是相同条件下氢气密度的__________倍。
(3)12.4 g Na2R含Na+0.4 mol,则R的相对原子质量为_____________。
(4)已知16 g肼(N2H4)含有的电子数为b,则阿伏加德罗常数为______________。(用含b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为( )
A. C+H2O===CO+H2 ΔH=+131.3 kJ·mol-1
B. C(s)+H2O(g)===CO(g)+H2(g) ΔH=+10.94 kJ·mol-1
C. C(s)+H2O(l)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
D. C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某废催化剂(含Al2O3 36%、CoS 20%、MoS2 20%、MgO 8%等)为原料生产Co2O3的工艺路线如下:
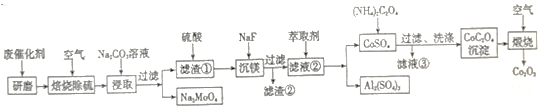
已知: 氧化铝有两种晶型α-Al2O3 和γ- Al2O3,α- Al2O3致密难溶于酸和碱。
(1)废催化剂焙烧前先将其研磨,其目的是_________________________。
(2)已知“焙烧除硫”后的产物有CoO、MoO3。写出Na2CO3溶液“浸取”过程的离子反应方程式:______________________。
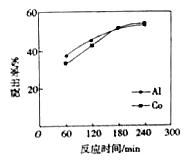
(3) 硫酸浸泡滤渣①的实验条件为硫酸浓度12 mol/L、液固比为3、反应温度60℃。该条件下,铝、钴浸出率与时间关系如图。当浸泡时间小于180 min时,铝、钴浸出率随着时间的推移均增加较快;180 min 后铝和钴的浸出率都提高不多,且钴浸出率高于铝浸出率。试解释180min后钴浸出率高于铝浸出率的原因: ____________________。
(4)萃取剂对Al3+、Co2+萃取率与pH 的关系如图。
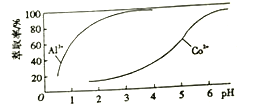
萃取分离钴、铝的实验操作为: 向萃取分液后的有机相中加硫酸调pH=3~4,分液可得CoSO4溶液,___________,可得Al2(SO4)3溶液。
(5)“滤液③”主要物质的化学成分是_______ (写化学式),用途之一为___________________。
(6)“煅烧”过程 相关反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 工业上电解熔融的Al2O3冶炼铝用铁做阳极
B. 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH
C. 用Pt做电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1∶2
D. 用碳棒做电极电解CuSO4溶液一段时间后,加入Cu(OH)2固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是
①验证蛋壳能否溶于酸②检验白酒中是否含有甲醇③鉴别食盐和小苏打④检验自来水中是否含有氯离子
A.①②B.②④C.③④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如下。
I.KCl作电解质
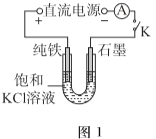
(1)一定电压下,按图-1装置电解,现象如下:
石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。
5min后U型管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体,10min后断开K。按图-2进行实验。
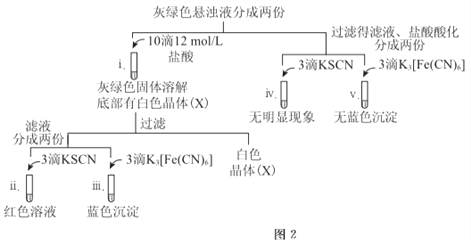
①石墨电极上的电极反应式是________。
②确认灰绿色固体中含有Fe2+的实验现象是_______。
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色。结合平衡移动原理,解释“试管i中析出白色晶体”的原因是_______。
(2)其他条件不变时,用图-3装置重复实验,10min后铁电极附近溶液依然澄清,断开K。按图-4进行实验
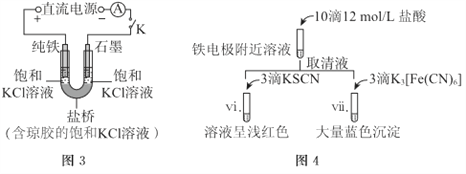
①盐桥的作用是_______。
②与实验I中vi、vii与ii~v中的现象比较,可以得出的结论是(答两点):_______。
II.KOH作电解质
(3)用图-1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液逐渐变为淡紫色(![]() ),没有沉淀产生。
),没有沉淀产生。
①铁电极上OH-能够放电的原因是______。
②阳极生成![]() 的总电极反应式是______。
的总电极反应式是______。
③某同学推测生成![]() 的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
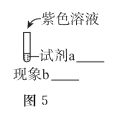 ______
______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.3g钠放入97.7g水中,下列说法正确的是
A. 电子转移的数目为2NA
B. 所得溶液的质量分数是等于4%
C. 产生气体的体积为1.12L
D. 产生的气体含有0.1mol的电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com