
| A. | 22a | B. | 44a | C. | $\frac{44a}{3}$ | D. | 14a |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
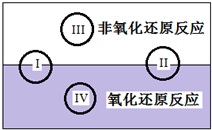 氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:
氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②③④ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D分子的空间构型为V型.
;D分子的空间构型为V型.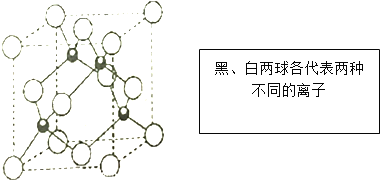
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.4mol•L-1 34.7% | B. | 20.4mol•L-1 38.5% | ||
| C. | 18.4mol•L-1 38.5% | D. | 20.4mol•L-1 34.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml 0.2mol/L的NaCl溶液 | B. | 50ml 0.1mol/L的Na2SO4溶液 | ||
| C. | 150ml 0.2mol/L的NaNO3溶液 | D. | 1000ml 0.2mol/L的Na2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.24 mol/L | B. | 0.6 mol/L | C. | 2.4 mol/L | D. | 4.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制单质氯:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ | |
| B. | 制单质镁:2Na+MgCl2$\frac{\underline{\;高温\;}}{\;}$2NaCl+Mg | |
| C. | 制聚氯乙烯:n CH2=CHCl $\stackrel{催化剂}{→}$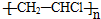 | |
| D. | 制纯碱:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com