

 2NH3(g);△H=2(a-b)kJ?mol-1;
2NH3(g);△H=2(a-b)kJ?mol-1;  2NH3(g);△H=2(a-b)kJ?mol-1;
2NH3(g);△H=2(a-b)kJ?mol-1;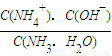 =
=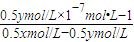 =
=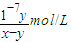 ,
,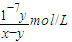 ;
;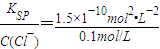 =1.5×10-9mol/L,
=1.5×10-9mol/L,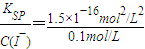 =1.5×10-15mol/L,所以氯化银会转化为碘化银,看到的现象为:白色沉淀转化为黄色沉淀,方程式为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
=1.5×10-15mol/L,所以氯化银会转化为碘化银,看到的现象为:白色沉淀转化为黄色沉淀,方程式为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).

科目:高中化学 来源: 题型:阅读理解

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 2 |
- 6 |
+ 2 |
- 6 |
+ 4 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
| ||
| (一定条件) |
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 10-7y |
| x-y |
| 10-7y |
| x-y |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com