
【题目】常温下,将 1molCaC2O4 粉末置于盛有500mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3 固体的过程中,溶液中Ca2+ 和 CO32-的浓度变化曲线如图所示,下列说法中不正确的是
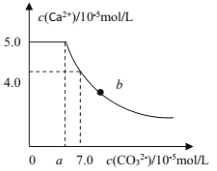
A.a=5.6
B.常温下,Ksp(CaC2O4)>Ksp(CaCO3)
C.b 点对应的溶液中,离子浓度关系为c(C2O42-) <c(CO32-)
D.若使 1molCaC2O4 全部转化为 CaCO3,至少要加入 2.12molNa2CO3
【答案】B
【解析】
A.c(CO32-)=7.0×10-5mol·L-1时,c(Ca2+)=4.0×10-5mol·L-1,Ksp(CaCO3)=7.0×10-5×4.0×10-5=2.8×10-9,当c(Ca2+)=5.0×10-5mol·L-1时,a×10-5mol·L-1=c(CO32-)=![]() =5.6×10-5mol·L-1,a=5.6,故A正确;
=5.6×10-5mol·L-1,a=5.6,故A正确;
B.1molCaC2O4 粉末置于盛有500mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,CaC2O4和CaCO3之间能转化,是改变离子的浓度,使沉淀的转化平衡向不同的方向移动,不能判断Ksp(CaC2O4)和Ksp(CaCO3)的大小,故B错误;
C.从图中当c(CO32-)在0~a时,溶液为CaC2O4的饱和溶液,c(C2O42-) 的最大值为5.6×10-5mol·L-1,b 点对应的溶液中,离子浓度关系为c(C2O42-) <c(CO32-),故C正确;
D.若使 1molCaC2O4 全部转化为 CaCO3,则此时溶液中c(C2O42-)=![]() =2mol·L-1,根据Ksp(CaC2O4)=c(Ca2+)·c(C2O42-)=5.0×10-5×5.0×10-5,可知此时溶液中c(Ca2+)=1.25×10-9mol·L-1,而根据Ksp(CaCO3)=2.8×10-9可知溶液中的c(CO32-)=
=2mol·L-1,根据Ksp(CaC2O4)=c(Ca2+)·c(C2O42-)=5.0×10-5×5.0×10-5,可知此时溶液中c(Ca2+)=1.25×10-9mol·L-1,而根据Ksp(CaCO3)=2.8×10-9可知溶液中的c(CO32-)=![]() == 2.240mol·L-1,故溶液中n(CO32-)=2.240mol·L-1×0.5L=1.12mol,而还有生成的1mol碳酸钙,故所需的碳酸钠的物质的量n=1.12mol+1mol=2.12mol,故D正确;
== 2.240mol·L-1,故溶液中n(CO32-)=2.240mol·L-1×0.5L=1.12mol,而还有生成的1mol碳酸钙,故所需的碳酸钠的物质的量n=1.12mol+1mol=2.12mol,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400℃时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用下列装置对NH4ClO4的分解产物进行探究。(假设装置内试剂均足量,部分夹持装置已省略)。
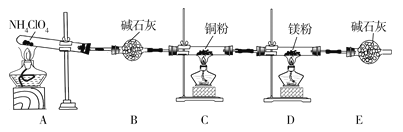
(1)在实验过程中发现C中铜粉由红色变为黑色,说明分解产物中有__(填化学式)。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为__。
(3)通过上述实验现象的分析,某同学认为产物中还应有H2O,可能有Cl2。该同学认为可能有Cl2存在的理由是__。
(4)为了证明H2O和Cl2的存在,选择上述部分装置和下列提供的装置进行实验:
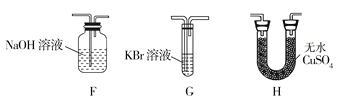
①按气流从左至右,装置的连接顺序为A→__→__→__。
②F中发生反应的离子方程式为__。
(5)实验结论:NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为___。
(6)在实验过程中仪器E中装有碱石灰的目的__;实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果__(填“偏大”“偏小”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体F的一种合成路线如图:
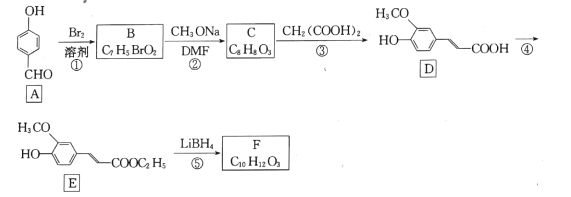
已知:RCOOR′![]() RCH2OH+R′OH(R为H或烃基,R'为烃基)
RCH2OH+R′OH(R为H或烃基,R'为烃基)
回答下列问题;
(1)A中官能团名称是 __________。
(2)反应①的反应类型是 ____。
(3)反应②的化学方程式为 ___________。
(4)反应④所需的试剂和条件是______________。
(5)F的结构简式为____。
(6)芳香化合物W是E的同分异构体,W能水解生成X、Y两种化合物,X、Y的核磁共振氢谱均有3组峰,X的峰面积比为3:2:1,Y的峰面积为1:1:1,写出符合题意的W的结构简式 ___(写一种)。
(7)肉桂酸![]() 广泛用于香料工业与医药工业,设计以苯甲酸甲酯和丙二酸为起始原料制备肉桂酸的合成路线:_______________(无机试剂任用)。
广泛用于香料工业与医药工业,设计以苯甲酸甲酯和丙二酸为起始原料制备肉桂酸的合成路线:_______________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物说法不正确的是( )
A.BrCH2CHBrCH2Br的名称为三溴丙烷
B.萘环![]() 上的一个H原子被一C4H9取代后的产物共有8种
上的一个H原子被一C4H9取代后的产物共有8种
C.对甲基苯乙烯中最多有17个原子共面
D.立方烷 一氯代物1种、二氯代物有3种、三氯代物也有3种
一氯代物1种、二氯代物有3种、三氯代物也有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:C2H5OH+NaBr+H2SO4(浓)![]() NaHSO4+C2H5Br+H2O,实验室用如图所示装置制备溴乙烷(沸点为38.4℃,密度为1.43g·mL-1)。
NaHSO4+C2H5Br+H2O,实验室用如图所示装置制备溴乙烷(沸点为38.4℃,密度为1.43g·mL-1)。
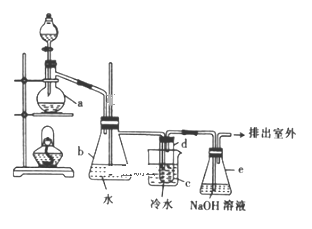
实验前先向仪器a中加入10g乙醇和足量浓硫酸,然后加入研细的20.6g溴化钠和几粒碎瓷片,向试管d中加人少量蒸馏水。
回答下列问题:
(1)加入碎瓷片的作用是__。
(2)试管d中出现的实验现象是___。
(3)反应结束后,试管d中含少量杂质Br2,为了除去粗产品中的杂质Br2,可选用的试剂是__填字母
A.苯 B.H2O C.Na2SO3溶液 D.CCl4
(4)经过分离、提纯、干燥后,该实验最终得到10.9g溴乙烷,则本实验溴乙烷的产率为___。
(5)通过以下几项实验步骤可检验溴乙烷中的溴元素,其正确的操作顺序是取少量溴乙烷___(填序号)。
①加热②加入AgNO3溶液③加入稀HNO3酸化④加入NaOH溶液⑤冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用付-克反应可制备芳香族化合物,如:![]() +C4H9Cl
+C4H9Cl![]() +HCl↑。下列有关说法不正确的是
+HCl↑。下列有关说法不正确的是
A.该反应为取代反应
B.![]() 属于烃的衍生物
属于烃的衍生物
C.分子式为C4H9Cl的物质有4种
D.![]() 能发生加成反应
能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组的同学在实验室利用现代先进仪器,获得了某有机物R的相关图谱如下:

回答下列问题:
(1)上图中,甲为_____图,获得该图谱所使用的仪器名称为_______;乙为_____图,获得该图谱所使用的仪器名称为__________________。
(2)已知R属于醇类物质
①结合图谱信息可推知R为 ___________(写名称),写出其与金属钠反应的化学方程式:________________。
②该有机物R_______(填“有”或“无”)同分异构体(不考虑立体结构),若有,请写出其同分异构体的结构简式:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s)+O2(g)=CO2(g)△H1
②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3
④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中正确的是( )
A.Na2S的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.NaHCO3的电离:NaHCO3![]() Na++H++CO32-
Na++H++CO32-
C.HSO3-的电离:HSO3-![]() H++SO32-
H++SO32-
D.硫氢化钠溶液呈碱性:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com