
| A. | NaOH固体 | B. | 同浓度的醋酸溶液 | ||
| C. | NH4Cl固体 | D. | CH3COONa固体 |
分析 一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,可以通过降低氢离子浓度来实现,但不影响生成氢气总量,说明加入的物质不能和铁反应生成氢气或加入的物质不能和盐酸反应生成其它气体.
解答 解:A.加入NaOH固体,氢离子浓度浓度不变,反应速率不变,故A不选;
B.加入同浓度的醋酸,醋酸和铁反应生成氢气,导致生成氢气总量增大,故B不选;
C.加入氯化铵固体,氯化铵水解生成的氢离子和铁反应生成氢气,导致生成氢气总量增大,故C不选;
D.加入醋酸钠固体,醋酸钠和稀盐酸反应生成醋酸,氢离子浓度减小,反应速率减慢,但最终电离出的氢离子物质的量不变,所以生成氢气总量不变,故D选;
故选D.
点评 本题考查化学反应速率影响因素,为高频考点,明确外界条件对化学反应速率影响原理是解本题关键,注意题干中限制性条件“反应速率减慢、生成氢气总量不变”,题目难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:解答题
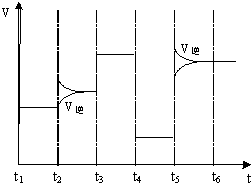 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:| 物质 T/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去水壶中的水垢 | B. | 氯气泄漏后应顺风向低处跑 | ||
| C. | 用铝锅炒菜比用铁锅好 | D. | 食用“加碘”食盐不利于健康 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 过滤时,应用玻璃棒搅拌漏斗中的待过滤液体 | |
| D. | 称量时,称量物放在称量纸(或称量器皿)上,置于托盘天平的左盘;砝码放在托盘天平的右盘中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁容器可盛装冷的浓H2SO4 | |
| B. | AgI胶体在电场中定向移动 | |
| C. | 金属K与水反应比金属钠与水反应剧烈 | |
| D. | 金属镁在空气中燃烧只生成MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com