
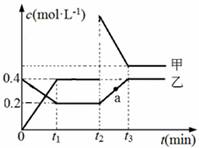
甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图所示。下列说法正确的是
A.甲是N2O4
B.a点处于平衡状态
C.t1~t2时间内v正(乙)<v逆(甲)
D.反应进行到t2时刻,改变的条件可能是升高温度
科目:高中化学 来源: 题型:
洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。

下列有关说法不正确的是
A .从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程
.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
C.在过程③⑤中溴元素均被氧化
D.过程①中除去粗盐中的SO 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.分子中键能越大,键长越长,则分子越稳定
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.在化学反应中,某元素由化合态变为游离态,该元素被还原
D.电子层结构相同的不同离子,其半径随核电荷数增多而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活密切相关。下列叙述错误的是
A.光导纤维和陶瓷都是硅酸盐产品
B.晶体硅可用于制造芯片
C.钢铁厂用热还原法冶炼铁
D.焙制糕点的发酵粉主要成分之一是碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z,其中X、Z同主族,Y、Z同周期,Z原子最外层电子数是X原子内层电子数的3倍,是Y原子最外层电子数的2倍。下列说法错误的是
A.Y位于第3周期 B.含X、Z的酸不只一种
C.原子半径:Y > Z D.气态氢化物稳定性:Z > X
查看答案和解析>>
科目:高中化学 来源: 题型:
4种短周期元素相对位置如右表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:
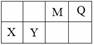
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) = 1.3×10-3 mol·L-1。则HR  H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入2 mol N2、3 mol H2,反应N2(g)+3H2(g) 2NH3(g)达到平衡时生成NH3的物质的量为m mol。
2NH3(g)达到平衡时生成NH3的物质的量为m mol。
(1)相同温度下,在乙中加入4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成NH3的物质的量为________ mol(从下列各项中选择,只填序号,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成NH3的物质的量为________mol。
A.小于m B.等于 m
C.在m~2m之间 D.等于2m
E.大于2m
(2)相同温度下,保持乙的容积为甲的一半,并加入1 mol NH3,要使乙中反应达到平衡时,各物质的体积分数与上述甲容器中达到平衡时相同,则起始时应加入________mol N2和________ mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
在可逆反应2SO2+O2 2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商) ( )。
2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商) ( )。
A.Qc不变,K变大,O2转化率增大
B.Qc不变,K变大,SO2转化率增大
C.Qc变小,K不变,O2转化率减小
D.Qc增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g)  2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.提高尾气净化效率的最佳途径是研制高效催化剂
B.提高尾气净化效率的常用方法是升高温度
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com