
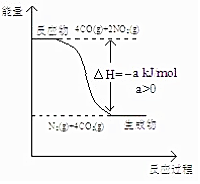
 研究 NOx、SO2、CO 等大气污染气体的处理具有重要意义.
研究 NOx、SO2、CO 等大气污染气体的处理具有重要意义.分析 (1)注明物质的聚集状态与反应热书写热化学方程式;
(2)发生反应:4CO+2NO2=N2+4CO2,计算CO物质的量,根据C元素化合价变化计算转移电子;由图可知4mol CO反应时放出热量为a kJ,进而计算放出热量;
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ•mol-1;
(4)NH3•H2O 是弱电解质,NaOH 是强电解质,NH3•H2O 存在电离平衡,NaOH 不存在电离平衡,将等pH的NH3•H2O 和NaOH 稀释后溶液的pH仍然相等,则NH3•H2O 稀释的倍数大于NaOH;
(5)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较pH,再按照溶液中氢离子浓度越大,则其pH越小,按照溶液中氢离子浓度由小到大顺序进行排列.
解答 解:(1)已知1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,因此反应的热化学方程式为:CO(g)+$\frac{1}{2}$SO2(g)=$\frac{1}{2}$S(s)+CO2(g)△H=-135kJ/mol,
故答案为:CO(g)+$\frac{1}{2}$SO2(g)=$\frac{1}{2}$S(s)+CO2(g)△H=-135kJ/mol;
(2)发生反应:4CO+2NO2=N2+4CO2,CO物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,根据C元素化合价变化可知转移电子为1mol×2=2mol;由图可知4mol CO反应时放出热量为a kJ,则0.1mol CO反应放出的热量为a kJ×$\frac{0.1mol}{4mol}$=0.025a kJ,
故答案为:2;0.025a;
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ•mol-1,则(-574KJ•mol-1+△H2)×$\frac{1}{2}$=-867KJ•mol-1,
解得△H2=-1160KJ/mol,
故答案为:-1160KJ/mol;
(4)NH3•H2O 是弱电解质,NaOH 是强电解质,NH3•H2O 存在电离平衡NH3•H2O?NH4++OH-,NaOH 不存在电离平衡,若将等 pH、等体积的 NaOH 溶液和 NH3•H2O 溶液分别加水稀释 m 倍、n 倍,稀释后溶液的pH仍然相等,则NaOH 稀释的倍数小于NH3•H2O,
故答案为:<;
(5)等物质的量浓度的下列溶液:①NaCl ②NaOH ③CH3COOH ④HCl ⑤CH3COONa ⑥Ba(OH)2,
属于碱的为:⑥Ba(OH)2②NaOH,浓度相同时,碱性及pH为⑥>②;
水解呈碱性的为:⑤CH3COONa,
溶液呈中性的为:①NaCl;
溶液呈酸性的有:③CH3COOH ④HCl,HCl完全电离为一元强酸,CH3COOH 为一元弱酸,浓度相同时,溶液的pH:③>④,
综合以上分析可知,溶液的pH由大到小的顺序是为:⑥②⑤①③④,
故答案为:⑥②⑤①③④.
点评 本题考查反应热有关计算、热化学方程式书写、溶液的稀释、溶液pH的大小比较等知识,注意对盖斯定律理解与灵活应用,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:选择题
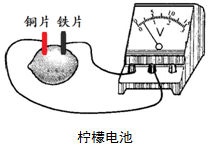
| A. | 铜片上发生反应:Cu-2e-═Cu2+ | B. | 铁片是负极,其质量逐渐减小 | ||
| C. | 电流由铁片经导线流向铜片 | D. | 柠檬中蕴含的电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| B. | 氯气与氢氧化钾溶液反应:Cl2+OH-═Cl-+ClO-+2H2O | |
| C. | 硫酸铝与氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 小苏打溶液与稀盐酸反应:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Rn+>Zm- | |
| B. | 若Y的最高价氧化物对应的水化物HnY0m为强酸,则X的氢化物沸点一定比Y的氢化物的沸点低 | |
| C. | 若X的气态氢化物能使湿润的石蕊试纸变蓝,则标准状况下,18g Y的氢化物的体积为2.24 L | |
| D. | 若R(OH)n为弱电解质,则W(OH)n+1可与KOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中只能含离子键 | |
| D. | 只有非金属原子间才能形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | F2与NaOH溶液反应:F2+4OH-═2F-+O2+2H2O | |
| C. | AgNO3溶液中加入少量氨水:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 终点溶液偏碱性 | B. | 终点溶液中c(NH4+)=c(Cl-) | ||
| C. | 终点溶液中氨过量 | D. | 合适的指示剂是甲基橙而非酚酞 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com