
| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管、烧杯 |
| B | 用碱石灰除去氢气中混有的水蒸气并收集氢气 | 洗气瓶、导气管、集气瓶 |
| C | 用氢氧化钠和醋酸溶液测中和反应的中和热 | 烧杯、玻璃棒、温度计 |
| D | 分离苯和四氯化碳的混合物 | 分液漏斗、烧杯、玻璃棒 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.利用加热分解法可比较稳定性;
B.碱石灰可盛放在球形干燥管中;
C.应使用环形玻璃搅拌棒,效果好;
D.苯和四氯化碳互溶,沸点不同.
解答 解:A.利用加热分解法可比较稳定性,则选择仪器为酒精灯、试管、导气管、烧杯,观察烧杯中石灰水是否变浑浊可比较,故A正确;
B.碱石灰为固体干燥剂,可盛放在球形干燥管中,不能利用洗气瓶,故B错误;
C.应使用环形玻璃搅拌棒,效果好,玻璃棒与溶液的接触面积小,故C错误;
D.苯和四氯化碳互溶,沸点不同,不能用分液的方法分离,应选蒸馏烧瓶、冷凝管等,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握稳定性比较、混合物分离提纯、中和热测定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | C14H10O5 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H18O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 用途 |
| A | Fe3+有氧化性 | 可用饱和FeCl3溶液制备Fe(OH)3胶体 |
| B | SiO2有导电性 | 可用SiO2制光导纤维 |
| C | NH3有还原性 | 可用NH3制取NO |
| D | 浓HNO3有酸性 | 可用铁制容器盛放浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
  | ||||
| 酸 | 碱 | 盐 | … | |
| 实例 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO3或K2SO3 | ⑦SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构.
据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n在自然界中能以游离态存在 | |
| B. | m的非金属性一定大于n | |
| C. | 最高价氧化物对应水化物的酸性:p>n | |
| D. | 氢化物的还原性:n>q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
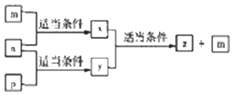 A、B,C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、C、B、的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且z是用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
A、B,C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、C、B、的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且z是用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )| A. | D的单质起火燃烧时可用x作灭火剂 | |
| B. | 元素的非金属性:C>A>B | |
| C. | 原了半径:D>C>B>A | |
| D. | B与同族元素的氧化物可发生置换反应,并且做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为4.4g (假设该过程中所有液体进出口密闭) | |
| B. | b放电的电极反应式为SO32-+H2O-e-═SO42-+2H+ | |
| C. | 电子由a经内电路流向b电极 | |
| D. | 图中b极连接电源的正极,C 口流出的物质是亚硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com