
【题目】CuCl广泛应用于化工和印染等行业.某研究性学习小组拟热分解CuCl22H2O制备CuCl,并进行相关探究.
【资料查阅】
【实验探究】
该小组用如图所示装置进行实验(夹持仪器略).
请回答下列问题:
(1)仪器X的名称是 .
(2)实验操作的先后顺序是a→→e(填操作的编号)
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 .
(4)装置D中发生的氧化还原反应的离子方程式是 .
(5)【探究反思】反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2 , 则产生的原因是 .
②若杂质是CuO,则产生的原因是 .
【答案】
(1)球形干燥管
(2)c﹣d﹣b
(3)先逐渐变为红色,后褪色
(4)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(5)加热温度不够;可能是没有在HCl的氛围中加热或者未等试管冷却就停止通入HCl气体
【解析】(1)由图及常见的仪器可知,仪器X的名称为球形干燥管,所以答案是:球形干燥管;(2)实验中有气体生成,先检验装置的气密性,且热分解CuCl22H2O制备CuCl,防止CuCl被氧化和Cu+水解所以必须要先赶走装置中的氧气和水蒸气后才加热,且要在HCl气流中加热制备,反应结束后先熄灭酒精灯,应该要继续通入氮气直至装置冷切,所以操作顺序为:a﹣c﹣d﹣b﹣e,所以答案是:c﹣d﹣b;(3)B中有白色变为蓝色,说明有水生成,产物中还有Cl2 , 所以C中石蕊试纸先逐渐变为红色,后褪色,所以答案是:石蕊试纸先逐渐变为红色,后褪色;(4)D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;(5)①由2CuCl2![]() 2CuCl + Cl2↑,杂质是CuCl2说明CuCl2没有反应完全,分解温度不高,所以答案是:加热温度不够;②杂质是氧化铜,说明CuCl被氧气氧化才产生了CuO,说明装置中有氧气,可能是没有在HCl的氛围中加热或者未等试管冷却就停止通入HCl气体,所以答案是:可能是没有在HCl的氛围中加热或者未等试管冷却就停止通入HCl气体.
2CuCl + Cl2↑,杂质是CuCl2说明CuCl2没有反应完全,分解温度不高,所以答案是:加热温度不够;②杂质是氧化铜,说明CuCl被氧气氧化才产生了CuO,说明装置中有氧气,可能是没有在HCl的氛围中加热或者未等试管冷却就停止通入HCl气体,所以答案是:可能是没有在HCl的氛围中加热或者未等试管冷却就停止通入HCl气体.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】CO的应用和治理问题属于当今社会的热点问题.
(1)汽车尾气中CO的治理,常用四氧化三钴(Co3O4)纳米棒的作催化剂,低温下与O2反应生成CO2 . 下列说法中正确的是(不定项选择)
A.该反应是分解反应
B.反应前后Co3O4化学性质不改变
C.反应前后碳元素的化合价不变
D.该反应的△H<0
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)制备.左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线.回答下列问题: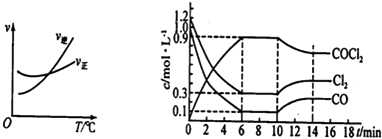
①0~6min内,反应的平均速率v(Cl2)=;
②若保持温度不变,在第8min加入体系中的三种物质各1mol,则平衡移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.8mol/L、c(CO)=0.6mol/L、c(COCl2)=mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
④该反应的平衡常数的表达式为K= , 随温度升高,该反应平衡常数变化的趋势为(填“增大”、“减小”或“不变”),原因为⑤比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8)T(15)(填“<”、“>”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
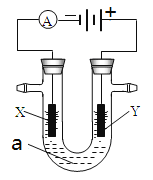
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应是______________。在X极附近观察到的现象是______________________________。
②Y电极上的电极反应式是______________。检验该电极反应产物的方法是______________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是___________________,电极反应式是______________。
②Y电极的材料是___________________,电极反应式是______________。
(说明:杂质发生的电极反应不必写出)
③假若电路中有0.04摩尔电子通过时,阴极增重________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究工业废弃物的处理和防治具有重要的意义.
(1)利用反应CH4+2NO2 ![]() N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是 , 当消耗CH4的体积是11.2L(标准状况下)时,理论上可处理molNO2 .
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是 , 当消耗CH4的体积是11.2L(标准状况下)时,理论上可处理molNO2 .
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体.该反应的化学方程式为
(3)某工厂排放的工业废水中可能含有Fe3+、Al3+、Cu2+ , 为了减少环境污染,变废为宝,利用废铁屑制得Fe2O3、Al2O3和金属Cu,过程如下.
①固体A的成分是 . (填化学式)
②溶液B中的阳离子有 .
③D与过量H溶液反应生成E的离子方程式是 .
④溶液E焰色呈黄色,试剂H是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是( )
A.H2C=CH2+HCl→H3C﹣CH2Cl
B.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.2C6H6+15O2 ![]() 12CO2+6H2O
12CO2+6H2O
D.CH3CH3+Cl2→CH3CH2Cl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3.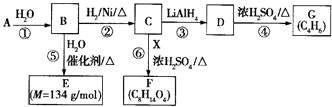
已知:  (其中R是烃基)
(其中R是烃基)
有关物质的转化关系如右图所示,请回答以下问题:
(1)A中不含氧的官能团的名称是;⑤的反应类型是 . G的结构简式为;G与Br2的CCl4溶液反应,产物有种(不考虑立体异构).
(2)反应②的化学方程式为 .
(3)E可在一定条件下通过(填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式:(两种即可).
(4)反应⑥的化学方程式为 .
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式: . Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用以下装置制取并探究氨气的性质.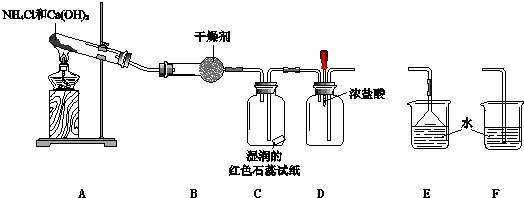
(1)A中反应的化学方程式是 .
(2)B中的干燥剂是 .
(3)C中的现象是 .
(4)实验进行一段时间后,挤压D装置中的胶头滴管,滴入1﹣2滴浓盐酸,可观察到的现象是 .
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气处理装置,应选用的装置是(填“E”或“F”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com