
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
T K时,向2.0L恒容密闭容器中充入1.0mol COCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
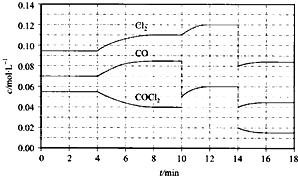
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
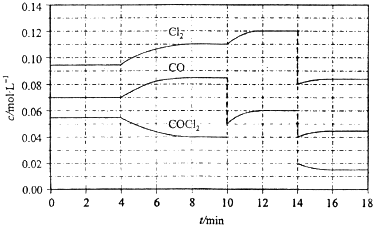
| A、COCl2在5~6 min和15~16 min时平均反应速率:v(5~6)>v(15~16) | B、第10 min时,改变反应条件,反应重新达到平衡前:v(正)<v(逆) | C、第12 min时,反应重新达到平衡,c(COCl2)≈0.03 mol?L-1 | D、第14 min时,改变的条件是减小压强,随着平衡的移动,COCl2的转化率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com