
| ŃōĄė×Ó | H+”¢Na+”¢A13+”¢Ag+”¢Ba2+ |
| ŅõĄė×Ó | OH-”¢C1-”¢CO32-”¢NO3-”¢SO42- |
·ÖĪö ¢ŁA”¢BĮ½ČÜŅŗ³Ź¼īŠŌ£¬½įŗĻĄė×ӵĹ²“ęæÉÖŖ£¬Ó¦ĪŖBa£ØOH£©2”¢Na2CO3ÖŠµÄŅ»ÖÖ£¬C”¢D”¢EČÜŅŗ³ŹĖįŠŌ£¬Ó¦ĪŖAgNO3”¢ĮņĖįĀĮ”¢HClÖŠµÄŅ»ÖÖ£»
¢ŚAČÜŅŗÓėEČÜŅŗ·“Ó¦¼ČÓŠĘųĢåÓÖÓŠ³Įµķ²śÉś£»AČÜŅŗÓėCČÜŅŗ·“Ó¦Ö»ÓŠĘųĢå²śÉś£¬ŌņAĪŖNa2CO3£¬BĪŖBa£ØOH£©2£¬EĪŖAl2£ØSO4£©3£¬CĪŖHCl£»
¢ŪDČÜŅŗÓėĮķĶāĖÄÖÖČÜŅŗ·“Ó¦¶¼ÄܲśÉś³Įµķ£»CÖ»ÄÜÓėD·“Ó¦²śÉś³Įµķ£¬ŌņDĪŖAgNO3£¬Č»ŗó½įŗĻĪļÖŹµÄŠŌÖŹ¼°»ÆѧÓĆÓļĄ“½ā“š£®
½ā“š ½ā£ŗ¢ŁA”¢BĮ½ČÜŅŗ³Ź¼īŠŌ£¬øł¾ŻĄė×Ó¹²“ęæÉÖŖ£¬A”¢BÓ¦ĪŖBa£ØOH£©2”¢Na2CO3ÖŠµÄŅ»ÖÖ£¬C”¢D”¢EČÜŅŗ³ŹĖįŠŌ£¬Ó¦ĪŖAgNO3”¢Al2£ØSO4£©3”¢HClÖŠµÄŅ»ÖÖ£»
¢ŚAČÜŅŗÓėEČÜŅŗ·“Ó¦¼ČÓŠĘųĢåÓÖÓŠ³Įµķ²śÉś£¬AČÜŅŗÓėCČÜŅŗ·“Ó¦Ö»ÓŠĘųĢå²śÉś£¬ŌņAĪŖNa2CO3£¬BĪŖBa£ØOH£©2£¬EĪŖAl2£ØSO4£©3£¬CĪŖHCl£»
¢ŪDČÜŅŗÓėĮķĶāĖÄÖÖČÜŅŗ·“Ó¦¶¼ÄܲśÉś³Įµķ£¬CÖ»ÄÜÓėD·“Ó¦²śÉś³Įµķ£¬ŌņDĪŖAgNO3£¬
£Ø1£©ÓÉŅŌÉĻ·ÖĪöæÉÖŖAĪŖNa2CO3£¬BĪŖBa£ØOH£©2£¬CĪŖHCl£¬DĪŖAgNO3£¬EĪŖAl2£ØSO4£©3£¬
¹Ź“š°øĪŖ£ŗBa£ØOH£©2£»HCl£»AgNO3£»Al2£ØSO4£©3£»
£Ø2£©EĪŖAl2£ØSO4£©3£¬µĪ¼Ó¹żĮæ°±Ė®Éś³ÉĒāŃõ»ÆĀĮ³Įµķ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗAl3++3NH3•H2O?Al£ØOH£©3”ż+3NH4+£¬
¹Ź“š°øĪŖ£ŗAl3++3NH3•H2O?Al£ØOH£©3”ż+3NH4+£»
£Ø3£©AĪŖNa2CO3£¬¼ģŃéAÖŠµÄŃōĄė×ÓÄĘĄė×ӵķ½·ØĪŖÓĆ½ą¾»µÄ²¬ĖæÕŗČ”“ż²āŅŗ£¬ŌŚ¾Ę¾«µĘ»šŃęÉĻ×ĘÉÕ£¬ČōŃęÉ«·“Ó¦ĻŌ»ĘÉ«£¬Ö¤Ć÷ŹĒÄĘĄė×Ó£¬
¹Ź“š°øĪŖ£ŗÓĆ½ą¾»µÄ²¬ĖæÕŗČ”“ż²āŅŗ£¬ŌŚ¾Ę¾«µĘ»šŃęÉĻ×ĘÉÕ£¬ČōŃęÉ«·“Ó¦ĻŌ»ĘÉ«£¬Ö¤Ć÷ŹĒÄĘĄė×Ó£»
£Ø4£©EĪŖAl2£ØSO4£©3£¬n£ØAl2£ØSO4£©3£©=0.1L”Į0.1mol/L=0.01mol£¬n£ØNaOH£©=0.035L”Į2mol/L=0.07mol£»
Ōņn£ØAl3+£©=0.02mol£¬n£ØOH-£©=0.07mol£¬
·¢Éś£ŗAl3++3OH-=Al£ØOH£©3”ż£¬
0.02mol 0.06mol 0.02mol
Al£ØOH£©3+OH-=AlO2-+2H2O£¬
0.01mol 0.01mol
ĖłŅŌ·“Ó¦ŗó£¬Éś³É0.01molAl£ØOH£©3ŗĶ0.01molAlO2-£¬µĆµ½³ĮµķĪļÖŹµÄĮæĪŖ0.01mol£¬
¹Ź“š°øĪŖ£ŗ0.01£®
µćĘĄ ±¾Ģāæ¼²éĮĖ³£¼ūĄė×ӵļģŃ飬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬ĢāÄæÅضČÖŠµČ£¬øł¾ŻĄė×ӵĹ²“ę”¢Ąė×ӵĊŌÖŹĄ“ĶʶĻĪļÖŹŹĒ½ā“š±¾ĢāµÄ¹Ų¼ü£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĘĻĢŃĢĒŗĶÕįĢĒ | B£® | ÕįĢĒŗĶĀóŃæĢĒ | C£® | µķ·ŪŗĶĻĖĪ¬ĖŲ | D£® | ½ŗĆŽŗĶ»šĆŽ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
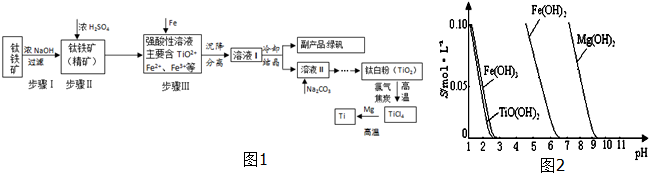
| TiCl4 | Mg | MgCl2 | Ti | |
| ČŪµć/”ę | -25.0 | 648.8 | 714 | 1667 |
| ·Šµć/”ę | 136.4 | 1090 | 1412 | 3287 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | XY2Ņ»¶ØŹĒ·Ö×Ó¾§Ģå | B£® | XY2µÄµē×ÓŹ½æÉÄÜŹĒ | ||
| C£® | XY2Ė®ČÜŅŗ²»æÉÄܳŹ¼īŠŌ | D£® | XæÉÄÜŹĒ¢ōA”¢¢õA»ņ¢öA×åŌŖĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
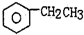 £Øg£©$\stackrel{560”ę}{?}$
£Øg£©$\stackrel{560”ę}{?}$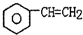 £Øg£©+H2£Øg£©”÷H£¼0
£Øg£©+H2£Øg£©”÷H£¼0| A£® | ¼ÓČėŹŹµ±“߻ƼĮ£¬æÉŅŌĢįøßŅŅ±½µÄ×Ŗ»ÆĀŹ | |
| B£® | ŌŚ±£³ÖĢå»żŅ»¶ØµÄĢõ¼žĻĀ£¬³äČė½Ļ¶ąµÄŅŅ±½£¬æÉŅŌĢįøßŅŅ±¾µÄ×Ŗ»ÆĀŹ | |
| C£® | ŌŚ¼ÓČėŅŅ±½ÖĮ“ļµ½Ę½ŗā¹ż³ĢÖŠ£¬»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä | |
| D£® | ½ö“ÓĘ½ŗāŅĘ¶ÆµÄ½Ē¶Č·ÖĪö£¬¹¤ŅµÉś²ś±½ŅŅĻ”Ń”ŌńŗćŃ¹Ģõ¼žÓÅÓŚŗćČŻĢõ¼ž |
²éæ““š°øŗĶ½āĪö>>
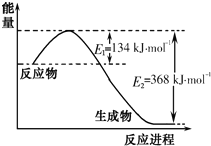
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
| T/K | 298 | 398 | 498 |
| Ę½ŗā³£ŹżK | 51 | K1 | K2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 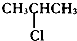 | B£® | CH3CH2Cl | C£® | 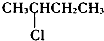 | D£® | CH3CH2CH2Cl |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com