
某化学实验小组,通过Li3N固体水解生成氢氧化锂和氨气的反应制氨气,并进行氨气还原氧化铜的实验探究。如下图所示,给出了本实验可供选择的装置:
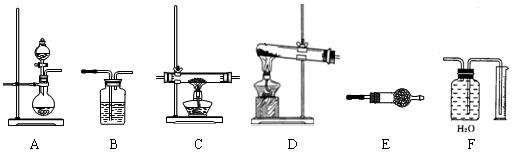
请回答下列问题:
(1)按该方法制氨气时,应选用上述装置中的 (填装置代码,下同)做氨气发生装置。
(2)为检验氨气还原氧化铜反应后生成Cu、H2O、N2,氨气发生装置后应依次连接 → C → → →
(3)在C装置前后连接的装置中,填充的药品按前后顺序分别为 、 。
(4)有资料提出:CuO被还原时,当黑色固体完全变为红时,不一定完全转化为Cu,可能还含有Cu2O。已知查阅到一离子反应方程式:Cu2O+2H+=Cu2++Cu+H2O。依据该信息,若证明C处的红色固体中是否含有Cu2O ,请设计实验: 。
(5)实验时充分加热,至C装置质量不再减轻为止。实验完毕后,若实验测得收集的N2体积为aL(已折算为标准状况)。则若用CH4还原同样多CuO,理论上最少需要CH4的体积为(标准状况,用含字母a的代数式表示) L。
科目:高中化学 来源: 题型:
查看答案和解析>>
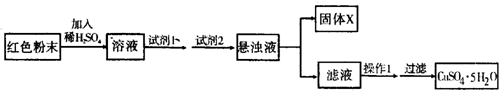
科目:高中化学 来源: 题型:阅读理解
| 9(b-a) |
| a |
| 9(b-a) |
| a |
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
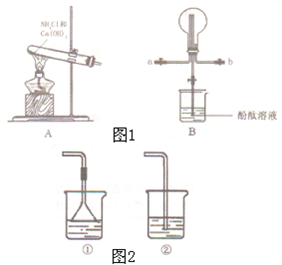 某化学实验小组同学利用如图1装置制备氨气,并探究氨气的性质(部分仪器已略去).
某化学实验小组同学利用如图1装置制备氨气,并探究氨气的性质(部分仪器已略去). 乙:
乙: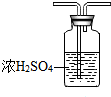 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.
某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.| 实验编号 | 实验操作 | 实验现象 |
| 1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
| 2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com