
| A. | 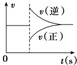 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 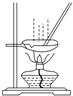 用图所示装置蒸发AlCl3溶液制备无水AlCl3 用图所示装置蒸发AlCl3溶液制备无水AlCl3 | |
| C. | 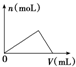 图可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 图可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 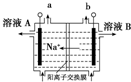 图电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B 图电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
分析 A.升高温度,正逆反应速率都增大,反之,都减小;
B、蒸发AlCl3溶液会促进铝离子的水解,得到的是氧化铝;
C、向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液过程中,产生的硫酸钡不会溶解;
D、电解饱和食盐水的装置中,阳极上产生氧气,氢氧根离子失电子,阴极上是氢离子浓度减小,生成氢气和氢氧化钠,氢氧化钠抑制水的电离.
解答 解:A.升高温度,正逆反应速率都增大,都大于原来平衡速率,降低温度,正逆反应速率都减小,都小于原来平衡速率,故A错误;
B、如图示的蒸发AlCl3溶液,会促进铝离子的水解,最后得到的是氧化铝固体,不能得到氯化铝,故B错误;
C、向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液,产生氢氧化铝和硫酸钡沉淀,氢氧化铝沉淀会逐渐溶解,氢氧化铝沉淀量会减小到零,故C正确;
D、图电解饱和食盐水的装置中,根据钠离子移向阴极,知道b是阳极,该极上产生氯气、氧气,氢氧根离子失电子,a是阴极,该电极上是氢离子浓度减小,生成氢气和氢氧化钠,溶液A、B中由水电离出的c(H+):A<B,故D错误.
故选C.
点评 本题考查较为综合,题目难度中等,本题易错点为C,注意有关反应的原理,熟悉物质的性质是关键.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题
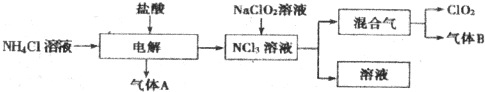
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
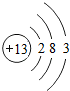 ,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”).
,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”). .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠常用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 切开的金属Na暴露在空气中,光亮表面会逐渐变暗 | |
| C. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| D. | 金属钠着火时,可以使用泡沫灭火器来灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
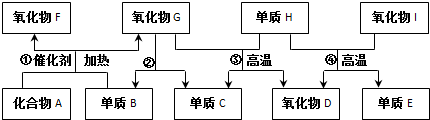
 .氧化物I中化学键类型:共价键.组成E单质的元素在元素周期表中的位置是第三周期第ⅣA族.图中物质所含元素原子的半径由大到小依次是(写元素符号)Si、C、N、O、H.
.氧化物I中化学键类型:共价键.组成E单质的元素在元素周期表中的位置是第三周期第ⅣA族.图中物质所含元素原子的半径由大到小依次是(写元素符号)Si、C、N、O、H. N2O4.
N2O4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:X<Y<Z | B. | 气态氢化物稳定性:XH3<YH3<ZH3 | ||
| C. | 元素的非金属性强弱:X>Y>Z | D. | 电子层数:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质都是天然有机高分子化合物 | |
| B. | 食用植物油的重要成分是高级不饱和脂肪酸甘油酯,不是天然高分子化合物 | |
| C. | 禁止使用含铅汽油是为了提高汽油的燃烧效率 | |
| D. | 碱液去污属于化学变化,洗涤剂去污主要是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10的烃,属于烯烃和环烷烃的同分异构体(不包括顺反异构)的种类分别为5、4 | |
| B. | 分子式为C28H52的烯烃,分子中含有C=C双键的数目是4(不含环状结构) | |
| C. | 分子式为C3H5Cl的链状化合物(考虑顺反异构)的同分异构体共有3种 | |
| D. | 分子式为C3H6的有机物最多存在3个C-C单键,与C4H10的碳碳单键数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com