
| 相关实验 | 预期目的 | |
| A | 将SO2通入溴水,溴水褪色 | 验证SO2的还原性 |
| B | 将氯水加入淀粉KI溶液中 | 验证Cl非金属性比I强 |
| C | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| D | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫具有还原性,能被强氧化剂氧化;
B.非金属的非金属性越强,其单质的氧化性越强;
C.金属的金属性越强,其单质与酸或水反应越剧烈;
D.应该根据熔融状态的物质是否带电判断离子化合物、共价化合物.
解答 解:A.溴具有强氧化性,二氧化硫能使溴水褪色,是因为二氧化硫和溴发生氧化还原反应生成硫酸和HBr,该反应中二氧化硫体现还原性,故A正确;
B.非金属的非金属性越强,其单质的氧化性越强,氯气能置换出碘,说明氯气的氧化性大于碘,则非金属性Cl>I,故B正确;
C.金属的金属性越强,其单质与酸或水反应越剧烈,Mg、Al分别与相同浓度、相同体积的盐酸反应时,Mg反应剧烈,说明金属性Mg>Al,故C正确;
D.共价化合物的水溶液也能导电,如硫酸、硝酸等,应该根据熔融状态的物质是否带电判断离子化合物、共价化合物,熔融状态下氯化铝不导电,说明氯化铝是共价化合物,故D错误;
故选D.
点评 本题考查化学实验方案评价,涉及共价化合物和离子化合物的判断、金属性及非金属性强弱判断、氧化还原反应等知识点,明确实验原理是解本题关键,知道金属性、非金属性强弱的判断方法有哪些,会从实验的评价性进行判断,易错选项是D,氯化铝属于共价化合物,为易错点.


科目:高中化学 来源: 题型:解答题
| 0 | 5min | 10min | 15min | 20min | 25min | |
| I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
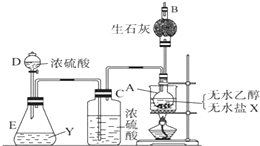 为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.
为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
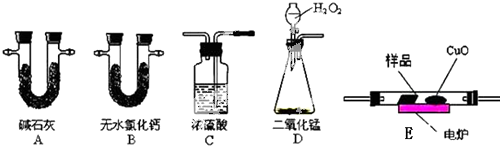
 取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
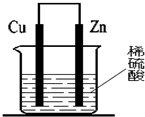
| A. | 电子从大量产生气泡的一极流出 | |
| B. | 反应一段时间后,溶液逐渐变为蓝色 | |
| C. | 逐渐溶解的一极上发生还原反应 | |
| D. | 烧杯内溶液中阳离子的物质的量浓度总和逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q1=Q | B. | 2Q1<Q | C. | 2Q1>Q | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)实验室制备HCl气体的反应为:
(1)实验室制备HCl气体的反应为:| 实验 次数 | 草酸溶液的体积 (mL) | ||
| 1 | 20.00 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com