
| A. | ①②⑤ | B. | ②③④ | C. | ①②④⑤ | D. | ①③④⑤ |
分析 ①分子的稳定性与氢键无关;
②SO2不能漂白紫色石蕊溶液;
③浓氨水与氯气反应生成氯化铵,会产生大量白烟;
④酸性条件下,硝酸根离子与碘离子先反应生成单质碘;
⑤过量的二氧化碳气体通入硅酸钠溶液,生成碳酸氢钠和硅酸,加热碳酸氢钠、硅酸均分解,最后又生成硅酸钠.
解答 解:①氢化物的稳定性与非金属的非金属性强弱有关,与氢键无关,氢键影响氢化物的熔沸点,故错误;
②SO2通入紫色石蕊溶液,溶液变红,因为是酸性氧化物,SO2不能漂白紫色石蕊溶液,所以溶液不褪色,故错误;
③浓氨水与氯气反应生成氯化铵,会产生大量白烟,所以可用浓氨水检验输送氯气的管道是否有泄漏,故正确;
④酸性条件下,硝酸根离子与碘离子先反应生成单质碘,在Fe(NO3)2溶液中通入过量碘化氢气体,最终碘离子被氧化为单质碘,故错误;
⑤过量的二氧化碳气体通入硅酸钠溶液,生成碳酸氢钠和硅酸,加热碳酸氢钠、硅酸均分解,则在高温下充分灼烧,碳酸钠和二氧化硅反应又生成硅酸钠,故错误.
故选C.
点评 本题考查较综合,涉及化学键、物质的性质等,注重高频考点的考查,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| B. | 将NH4Cl溶液蒸干制备NH4Cl固体 | |
| C. | 因为NH3能使酚酞溶液变红,NH3用于设计喷泉实验 | |
| D. | 浓氨水可检验氯气管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
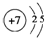 .
.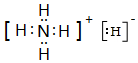 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
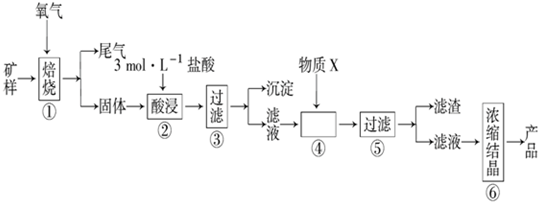
| 金属 离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加澄清的石灰水 | B. | 两者分别与同浓度的稀盐酸反应 | ||
| C. | 溶于水,比较其溶解性 | D. | 两者分别加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
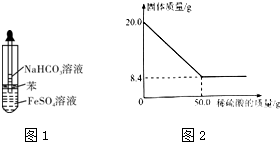
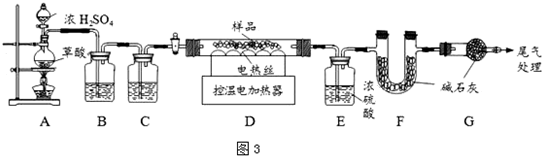
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
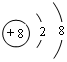 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com