
在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是 ( )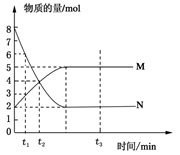
| A.t2时M与N的物质的量浓度之比为1:1 |
| B.t2与t3时刻的混合气体的平均相对分子质量相等 |
| C.反应物与生成物平衡时的物质的量浓度之比是2:5 |
D.0~t2内用M表示的平均反应速率是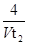 mol/(L?min) mol/(L?min) |
B
解析试题分析:根据图像可知,反应从开始到平衡,N的物质的量减小,应为反应物,物质的量变化值为8mol-2mol=6mol;M的物质的量增多,应为是生成物,物质的量的变化值为5mol-2mol=3mol,根据物质的量的变化与化学计量数呈正比,则有n(N):n(M)=6mol:3mol=2:1,所以反应的化学方程式为2N M。由图象可以看出t2时M与N的物质的量均是4mol,所以二者的物质的量浓度之比为1:1,A正确;t2时M与N的物质的量还是变化的,反应没有达到平衡状态,而t3时刻物质的浓度不再发生变化,说明反应达到平衡状态。由于反应前后体积是变化的,所以混合气的平均相对分子质量是变化的,则t2与t3时刻的混合气体的平均相对分子质量不相等,B不正确;由图像可知,反应物与生成物平衡时的物质的量浓度之比是2:5,C正确;0~t2内用M表示的平均反应速率是
M。由图象可以看出t2时M与N的物质的量均是4mol,所以二者的物质的量浓度之比为1:1,A正确;t2时M与N的物质的量还是变化的,反应没有达到平衡状态,而t3时刻物质的浓度不再发生变化,说明反应达到平衡状态。由于反应前后体积是变化的,所以混合气的平均相对分子质量是变化的,则t2与t3时刻的混合气体的平均相对分子质量不相等,B不正确;由图像可知,反应物与生成物平衡时的物质的量浓度之比是2:5,C正确;0~t2内用M表示的平均反应速率是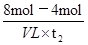 =
=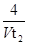 mol/(L?min),所以选项D正确,答案选B。
mol/(L?min),所以选项D正确,答案选B。
考点:考查可逆反应的有关计算以及平衡图象的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,综合性强,意在培养学生分析、归纳和总结问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。答题时注意把握图象中曲线的变化特点。


科目:高中化学 来源: 题型:单选题
已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
| A.图一的t2时刻和和图二的t1时刻改变的条件都有可能是升高了温度或增大了压强 |
| B.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
| C.图一表示在新条件下达到平衡时,v′(正)>v′(逆),图二表示在新条件下达到平衡时,v′(正)<v′(逆) |
| D.其它条件不变,分别使用不同催化剂上述反应的平衡常数均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:
3A(g)+2B(g) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K= |
| B.此时,B的平衡转化率是35% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加C,B的平衡转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对已达化学平衡的反应2X(g)+Y(g) 2Z(g),减小压强时,对反应产生的影响是( )
2Z(g),减小压强时,对反应产生的影响是( )
| A.逆反应速率增大正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
| A.a>b | B.a=b | C.a<b | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在2A+B  3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) =" 0.3" mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)=" 1" mol·L-1·S-1
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:
n(A)=n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(本题16分)
(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |

 ΔH >0
ΔH >0| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com