
| A、某温度下测得CH3COONa和CH3COOH混合溶液pH=7,则c(Na+)=c(CH3COO-) |
| B、0.1mol/L NH4HS溶液:c(NH4+)<c(HS-)+c(H2S)+c(S2-) |
| C、等浓度等体积的NH4Cl和HCl的混合溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、相同条件下,浓度相同的Na2CO3、C6H5ONa、CH3COONa和NaOH溶液,其pH关系为:pH (Na2CO3)>pH (CH3COONa)>pH (C6H5ONa)>pH (NaOH) |


科目:高中化学 来源: 题型:
| A、钠溶解,有Cu析出,并有气体产生 |
| B、钠溶解,有蓝色沉淀,有氢气产生 |
| C、有气体产生,无沉淀产生 |
| D、钠在液面逐渐消失,有气体产生和蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| B、向少量的火柴头浸泡液中滴加AgNO3、稀HNO3和NaNO2,检验火柴头中的氯元素 |
| C、在2mL紫色的CoCl2溶液中加入浓盐酸,可使溶液显蓝色 |
| D、制备摩尔盐时,最后在蒸发皿中蒸发浓缩溶液,加热至液体表面出现晶膜为止,不能将溶液全部蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同一原子中,4S、2P、4P能级的轨道数依次增多 |
| B、3P2表示3P能级有两个轨道 |
| C、处于最低能量的原子叫做基态原子 |
| D、同一原子中,1S、2S、3S电子的能量逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
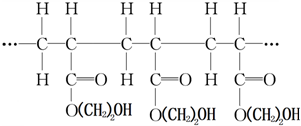
| A、它是缩聚反应的产物 |
| B、其单体是CH2=CH2COOH和HOCH2CH2OH |
| C、其链节是CH3CH2COO(CH2)2OH |
| D、其单体是CH2=CHCOO(CH2)2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第一电离能:③>①>② |
| B、原子半径:③>②>① |
| C、电负性:③>①>② |
| D、最高正化合价:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在容积固定为2L的密闭容器中,充入0.18molHI,480℃时反应:
在容积固定为2L的密闭容器中,充入0.18molHI,480℃时反应:| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com