
分析 离子均为无色,
由A、用PH试纸检验溶液,发现溶液呈强酸性,可知一定含H+,则不含CO32-;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,则一定不含Mg2+;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生,则白色沉淀为BaCO3,可知原溶液一定含Ba2+,则不含SO42-,结合溶液为电中性来解答.
解答 解:①离子均为无色,由A、用PH试纸检验溶液,发现溶液呈强酸性,可知一定含H+,则不含CO32-;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,则一定不含Mg2+;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生,则白色沉淀为BaCO3,可知原溶液一定含Ba2+,则不含SO42-,
结合溶液为电中性一定含阴离子为Cl-,不能确定是否含Na+,一定含H+、Ba2+、Cl-,一定不含Mg2+、SO42-、CO32-,
故答案为:H+、Ba2+、Cl-;Mg2+、SO42-、CO32-;Na+;
②C中发生反应的离子方程式为Ba2++CO32-=BaCO3↓,故答案为:Ba2++CO32-=BaCO3↓.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、常见离子之间反应与现象推断物质为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 为了增强其氧化性,在配制时加入一定浓度的盐酸 | |
| B. | 该物质在反应中可以被还原,也可以被氧化 | |
| C. | 可用酸化的KMnO4溶液除去甲烷中的乙烯 | |
| D. | KMnO4中Mn元素为其最高价+7,故含有最高价元素的化合物,均有强氧化性,如浓硫酸、浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
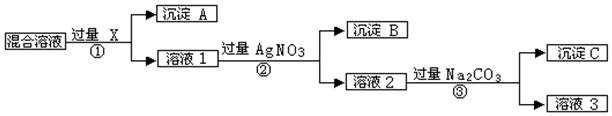
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
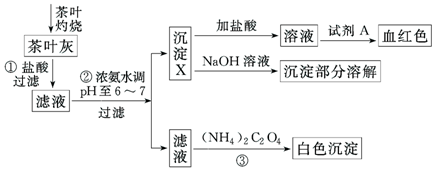
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
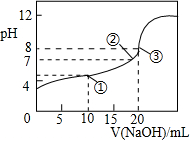 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )| A. | ①点时:c(ClO2-)>c(Na+)>c(H+)>c(OH-) | |
| B. | ②点时:c(Na+)=c(ClO2-) | |
| C. | ③点时:c(H+)=c(OH-)+c(HClO2) | |
| D. | 滴定过程中可能出现:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
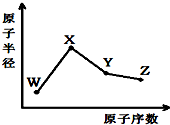 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| B. | 氯气和水反应:Cl2+H2O?2H++Clˉ+ClOˉ | |
| C. | 氯化铁溶液中加入足量的氨水:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com