
| n |
| V |
| c(碱)V(碱)-c(酸)V(酸) |
| V(酸)+V(碱) |
| 1 |
| 100 |
| 10-3mol |
| 2VL |
| c(OH-)V(碱)-c(H+)V(酸) |
| V(碱)+V(酸) |
| 0.1×V(碱)-0.01×V(酸) |
| V(碱)+V(酸) |
| 1 |
| 100 |
| 1 |
| 108 |


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
| A、当0.10mol?L-1醋酸溶液pH=3.0时达到电离平衡状态 |
| B、0.10mol?L-1醋酸溶液和0.0010mol?L-1醋酸溶液的c(H+)之比为100:1 |
| C、0.10mol?L-1醋酸钠溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、0.1 mol/L NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 |
| B、向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| C、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
| D、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
| B、将少量二氧化碳通入烧碱溶液中:CO2+OH-=HCO3- |
| C、向Ba(OH)2溶液中滴加NaHSO4溶液至刚好沉淀完全:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| D、NaHCO3溶液与NaHSO4溶液混合:HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
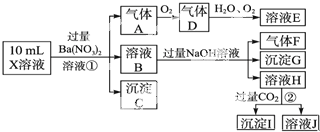
查看答案和解析>>
科目:高中化学 来源: 题型:
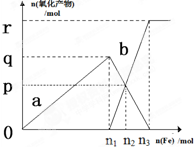 含有4.0mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(还原产物只有NO).下列有关判断正确的是( )
含有4.0mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(还原产物只有NO).下列有关判断正确的是( )| A、a是Fe(NO3)2 |
| B、n1=0.80 |
| C、p=0.60 |
| D、n3=1.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com