
| A. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 石油裂解主要目的是得到短链的不饱和烃 | |
| D. | 煤的气化与液化都是化学变化 |
分析 A.煤的成分中并不含有苯、甲苯等有机物;
B.含C18以上的固态烃利用率低,交通运输业需要更多的燃料油,使重油长链烃分子断裂就可以得到汽油;
C.石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃;
D.化学变化过程中有新物质生成,根据煤气化和液化原理分析.
解答 解:A.煤是由无机物和有机物组成的复杂混合物,可以用干馏方法获得苯和甲苯,但是煤的成分中并不含有苯、甲苯等有机物,它们是煤在干馏时经过复杂的物理化学变化产生的,故A错误;
B.使长链烃分子断裂为C5-C11烷烃的过程采用催化裂化的方法,故B正确;
C.石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃,故C正确;
D.煤的气化是煤在氧气不足的条件下进行部分氧化形成H2、CO等气体的过程,煤的液化是将煤与H2在催化剂作用下转化为液体燃料或利用煤产生的H2和CO通过化学合成产生液体燃料或其他液体化工产品,都属于化学变化,故D正确.
故选A.
点评 本题考查煤和石油的综合利用,题目难度不大.要熟记煤和石油的加工方法,原理和产品.


科目:高中化学 来源: 题型:多选题
| A. | 升高温度 | |
| B. | 恒温恒容再充入a mol CO和2a mol H2 | |
| C. | 恒温恒容再充入H2 | |
| D. | 充入Ar(g)使体系的总压增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
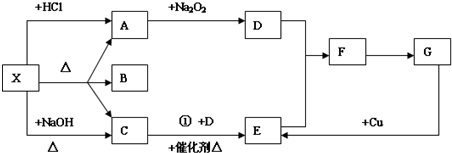
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
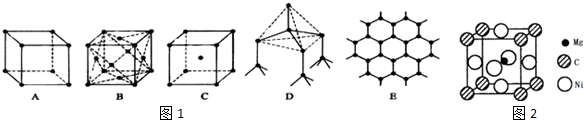
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和浓硫酸在空气中久置,酸溶液的浓度都会降低 | |
| B. | 和铜反应中都表现出强氧化性和酸性 | |
| C. | 浓硝酸常保存在棕色试剂瓶中 | |
| D. | 常温下,浓硝酸和浓硫酸不和铁、铝反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
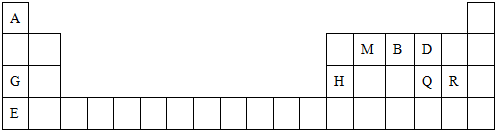
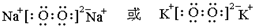 ;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.
;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
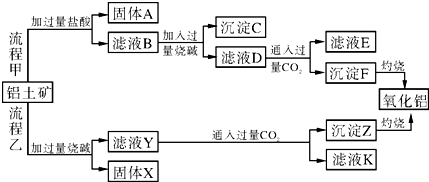
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com