
| A. | 中和滴定、pH试纸 | B. | 蒸馏、Na2CO3溶液 | ||
| C. | 电解、NaOH溶液 | D. | 酯化反应、石蕊试液 |
分析 确定醋酸的电离度,根据CH3COOH?CH3COO-+H+,应分别确定CH3COOH的物质的量和H+的物质的量,可用滴定法确定CH3COOH的物质的量,用pH试纸可粗略确定H+的物质的量,进而计算电离度.
解答 解:A.用滴定法确定CH3COOH的物质的量,用pH试纸可粗略确定H+的物质的量,进而计算电离度,故A正确;
B.醋酸酸性比碳酸强,醋酸与碳酸钠反应生成二氧化碳气体,无法确定H+的物质的量,不能计算电离度,故B错误;
C.醋酸与NaOH溶液发生中和反应,无法确定CH3COOH和H+的物质的量,不能计算电离度,故C错误;
D.石蕊试液只能确定溶液呈酸性,不能确定H+的物质的量,另外酯化反应属于可逆反应,不能确定CH3COOH的物质的量,故D错误.
故选A.
点评 本题考查弱电解质的电离,题目难度中等,注意根据电离度的定义确定实验方案,掌握实验基本操作是解题关键.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,请回答下列问题.
,请回答下列问题. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KNO3+3C+S$\frac{\underline{\;\;△\;\;}}{\;}$K2S+N2↑+3CO2↑ | B. | 2NaCl $\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | ||
| C. | 2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑ | D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


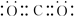
 ,该电子排布图错误的理由是违背了洪特规则.
,该电子排布图错误的理由是违背了洪特规则.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
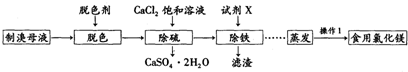
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5Na | |||||||||||
| B. | 用惰性电极电解足量氯化钠溶液,当阴极生成气体质量为2g时,溶液中转移电子数为2Na | |||||||||||
| C. | 一定温度下,若用Kw表示水的离子积,Kb表示一水合氨的电离常数,则该温度下水解平衡常数K=$\frac{{K}_{W}}{{K}_{b}}$ | |||||||||||
| D. | 已知如表所示数据:
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com