
下列物质的水溶液,因为水解而使溶液呈酸性的是
A.NaHSO4 B.NaHCO3 C.AlCl3 D.Na2SO4
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
相同温度下,100 mL 0.01 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是( )
A.c(OH-) B.c(H+) C.中和时所需NaOH的量 D.c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是____________;
(2)X与金属钠反应放出氢气,反应的化学方程式是__________________________(有机物用结构简式表示);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
( )
A.若质量相等,则质子数相等
B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等
D.若体积相等,则密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)(2013·宜春模拟)①含0.4 mol Al3+的Al2(SO4)3中所含的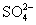 的物质的量是______________。
的物质的量是______________。
②2.3 g Na中含电子的物质的量为 mol,在跟足量水反应中失去电子的物质的量为 mol。
(2)(2013·阜新模拟)①48 g 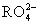 中,核外电子总数比质子总数多6.02×1023个,则R元素的摩尔质量为 。
中,核外电子总数比质子总数多6.02×1023个,则R元素的摩尔质量为 。
②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为 。
(3)(2013· 江西师大附中模拟)一定量的氢气在氯气中燃烧,所得混合物用
100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为___________________________;
②所得溶液中Cl-的物质的量为_________________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯水加热到较高温度,下列叙述正确的是
A.水的离子积变小,pH变大,呈碱性 B.水的离子积变大,pH变小,呈中性
C.水的离子积变大,pH变小,呈碱性 D.水的离子积不变,pH不变,呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下, 相同pH的盐酸和醋酸溶液分别加水稀释, pH 随溶液体积变化的曲线如图所示。据右图判断正确的是
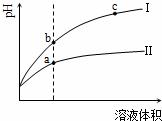
A.Ⅱ为盐酸稀释时的pH变化曲线
B.a点KW的数值比c点KW的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
水煤气法制甲醇工艺流程框图如下
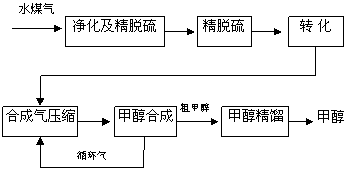
(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为 ;
②下列能提高碳的平衡转化率的措施是 。
A.加入C(s)
B.加入H2O(g)
C.升高温度
D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+3/2O2 (g) CO (g)+2H2O (g) △H=-519KJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) △H=-519KJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H1
CH3OH(g) △H1
已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
H2O(l)= H2(g)+ 1/2O2(g) △H=+285.8 kJ·mol—1
①上述反应中△H1= kJ·mol—1。
②T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
③若加入等物质的量的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1, c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com