
(12��)����ѪҺ��Ca2�����ӵ�Ũ��һ�����mg/mL����ʾ���������IJ����[(NH4)2C2O4]��Һ�������������(CaC2O4)���������˲���Ƴ���ϴ�Ӻ�����ǿ��ɵò���(H2C2O4)������KMnO4��Һ�ζ���ʹ����ת����CO2�ݳ����Իش�
��1������Ҫ80 mL 0.02 mol��L��1��KMnO4��Һ�����еζ�����������Һʱ��Ҫ�IJ����������ձ�����������______________________������ʱ�� KMnO4��ҺӦ��ǿ���ữ����ʵ��ѡ��________���ữ������ѡ��HNO3�ữ����������________(�ƫ��ƫС�����䡱)��
��2������������KMnO4��Һ��Ӧ�����ӷ���ʽΪ_______________________________��
��3���ζ�ʱ����������_______________________________________������ȷ����Ӧ�ﵽ�յ㡣
��4���ζ���ʵ������������ʾ��
ʵ���� | ����ѪҺ�����/mL | ����KMnO4��Һ�����/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
�������㣬ѪҺ��Ʒ��Ca2�����ӵ�Ũ��Ϊ________mg/mL��
��1��100 mL����ƿ����ͷ�ιܡ�ϡH2SO4��ƫС��ÿ��2�֣�
��2��5H2C2O4��2MnO4����6H��=10CO2����2Mn2����8H2O��2�֣�
��3����Һ����ɫ��Ϊ�Ϻ�ɫ�Ұ�����ڲ���ɫ��2�֣�
��4��1.2��2�֣�
��������
���������ȷ����һ������ĵ���Һ����Ҫʹ������ƿ��������80ml��ӽ�������ƿ�Ĺ����100ml������ƿ��������Ҫ80 mL 0.02 mol��L��1��KMnO4��Һ�����еζ�����������Һʱ��Ҫ�IJ����������ձ���������������Ҫ100 mL����ƿ����ͷ�ιܣ�����ʱ�� KMnO4��ҺӦ��ǿ���ữ�����������л�ԭ�ԣ������ĸ��������Һ���Dzⶨ�����ȷ��������ǿ�����ԣ�Ҳ��Ӱ����������ʹ�ã����Ա�ʵ��ѡ��ϡ�������ữ������ѡ��HNO3�ữ�������ĵĸ�����ؾ�ƫ�٣�ʹ�������ƫС����2������������KMnO4��Һ��Ӧ�����ӷ���ʽΪ5H2C2O4��2MnO4����6H��=10CO2����2Mn2����8H2O����3���ζ�ʱ�����ڶ��߷�Ӧ������Mn2+����ɫ�ģ�������������Һ����ɫ��Ϊ�Ϻ�ɫ�Ұ�����ڲ���ɫ������֤����Ӧ��ȫ���ﵽ�ζ��յ㡣��4���������ĵĸ��������Һ�������ֵ��֪�ڶ�������ƫ��̫��Ӧ����ȥ�������ĵĸ��������Һ������ǣ�11.95ml��12.05ml����2=12.00ml.���ݷ���ʽ��֪��5n(H2C2O4)��2n(MnO4��), n(H2C2O4)= (5��2)��n(MnO4��)= (5��2)��0.02 mol/L��0.012L=6��10-4mol.����C�غ��֪n(CaC2O4)= n(H2C2O4)= 6��10-4mol��m(Ca2+)=6��10-4mol��40g=0.024g, ����ѪҺ��Ʒ��Ca2�����ӵ�Ũ��Ϊ(0.024g��1000mg/g)��20ml=1.2mg/ml��
���㣺����������ѡ�����ӷ���ʽ����д���ζ��յ���жϡ��ζ���������Ũ�ȵļ����Ӧ�õ�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����������и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ˮ��Һ���ܴ��������һ��������
A��Na+��Ca2+��Cl-��SO42-
B��Mg2+��NH4+��Cl-��SO42-
C�� Fe2+��H+��SO32-��ClO-
D��K+��Fe3+��NO3-��SCN-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����һ�и�����ѧ9�¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��W����ԭ������������������ֶ�����Ԫ�ء������ڱ���Z��Y���ڣ�Z��WҲ���ڣ�Y��Z��W����Ԫ�ص�ԭ������������֮��Ϊ17��X�ֱܷ���Y��Z�γɵ���������ȵķ���A��B�������й��ж���ȷ���ǣ���
A��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ:W>Z>Y
B���������ζ����� X��Z��W����Ԫ�أ�����֮��ɷ�����ѧ��Ӧ
C��X��Y��Z��W��ԭ���γɵĻ�������ֻ���ڹ��ۼ�
D��������B�к��еĻ�ѧ��Ϊ�Ǽ��Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ2015�����9�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��14�֣���ҵ�����������ѵķ����ܶࡣ����������Ҫ�ɷ�FeTiO3������������Ϊ��Ҫԭ��ұ�������ѣ������Ĺ�������ͼ���£�������������Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽΪ��
FeTiO3��2H2SO4��TiOSO4��FeSO4��2H2O
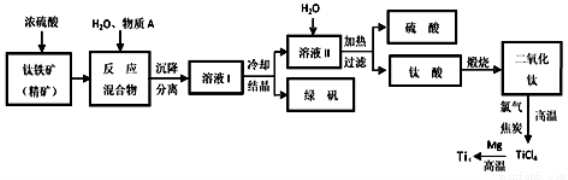
�ش��������⣺
��1���������Ũ���ᷴӦ����_________��ѡ�������ԭ��Ӧ����������ԭ��Ӧ������
��2���������������м�������A��Ŀ���Ƿ�ֹFe2��������������A��________�������Ʊ�TiO2�Ĺ����У����õ��ĸ�����Ϳɻ������õ����ʷֱ���__________��___________��
��3����ӦTiCl4��2Mg��2MgCl2��Ti��Ar�����н��е�������_____________________��
��4���ɶ���������ȡ���Ȼ������漰�ķ�Ӧ�У�
TiO2 (s)+ 2Cl2 (g) +2C(s) ��TiCl4(g) + 2CO(g)
��H1 = ��72 kJ?mol-1 TiO2(s) + 2Cl2 (g) ��TiCl4(g) + O2 (g)
��H2 =+38.8kJ?mol��1
C(s)��CO2(g)��2CO(g)? ��H3 =+282.8kJ?mol��1
�ٷ�ӦC(s)��CO2(g)��2CO(g)�ڸ������ܹ��Է�����
��ԭ����______________________��
�ڷ�ӦC(s)��O2(g)��CO2 (g)�Ħ�H��_______________��
��5���о����֣�������ʯī������������������������CaF2-CaO
������ʣ�������ͼ��ʾװ�û�ý����ƣ����Ը�Ϊ��ԭ������ԭ���������Ʊ������ѡ�
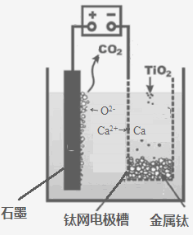
��д��������������Ӧ�ĵ缫��Ӧʽ��_______________________��
�����Ʊ�������ǰ��CaO���������䣬��ԭ���ǣ����ϻ�ѧ������ͣ� _________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ2015�����9�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ����
A����CO2ͨ��BaCl2��Һ�������ͣ�������������ͨ��SO2����������
B����ϡ�����м���ͭ�ۣ�ͭ�۲��ܽ⣻�ټ���Cu(NO3)2���壬ͭ���Բ��ܽ�
C����AlCl3��Һ�еμӰ�ˮ��������ɫ�������ټ������NaHSO4��Һ��������ʧ
D����п��ϡ���ᷴӦ�������������ʽ������ټ�������CuSO4���壬���ʲ��ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�������������ۿ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ֶ�����Ԫ�ص�ijЩ�������±���ʾ:
Ԫ�ش��� | X | W | Y | Z | Q |
ԭ�Ӱ뾶����10-12 m�� | 37 | 99 | 66 | 104 | 154 |
��Ҫ���ϼ� | +1 | -1��+7 | -2 | -2��+6 | +1 |
����˵����ȷ���ǣ� ��
A����Q��Y�γɵĻ�������ֻ�������Ӽ�
B��Z��X֮���γɵĻ�������л�ԭ��
C��X��YԪ����ɵĻ�����ķе����X��ZԪ����ɻ�����ķе�������Y�ǽ����Ա�Zǿ
D��Y��Q��W����Ԫ����ɻ������ˮ��Һһ���Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и���һ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣�A��B��C��D��E��F����Ԫ�أ�����A��B��C��D��EΪ����������Ԫ�ء�����֮��Ĺ�ϵ���£�
��I��ԭ�Ӱ뾶��A��C��B��E��D
��II��ԭ�ӵ�������������A=D��C=E��A��B=C
��III��ԭ�ӵĺ�����Ӳ�����B=C=2A
������F�ģ�3�������ӻ�̬�۵����Ų�Ϊ3d5
��ش�
��1��Bԭ�ӵĻ�̬ԭ�ӵ����Ų��������ܼ�������ȫ����������״̬����Bԭ�ӵĵ����Ų�ʽΪ ��
��2������A��C��Ԫ�ذ�ԭ�Ӹ�����2��1��ɳ����������VSEPRģ��Ϊ �����ӵ����幹��Ϊ ��
��3������Ԫ���У�A��B��C��E��F����Ԫ�ؿ��γ�һ�ֳ������Σ������ø���������������������Ӹ�����Ϊ1��1��2���������Һ�����ữ��BaCl2��Һ��������ɫ����������NaOH��Һ�����ȣ�������ʹʪ���ɫʯ����ֽ����ɫ�����壬��ø��εĻ�ѧʽ ��Ϊ���鸴����ij��ɫ���ӵĴ��ڣ���д�������ʵ����������� ��
��4��F��+3�������ڼ��������¿ɱ�NaClO����Ϊ+6�۵ĺ���������ӣ�ClO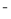 ����ԭΪCl
����ԭΪCl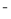 ��д����Ӧ�����ӷ���ʽ ��
��д����Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����һ�ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ȷ��ʾ���з�Ӧ�����ӷ���ʽ��
A��Na2O2����ˮ�Ʊ�O2��2O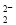 ��2H2O=4OH����O2��
��2H2O=4OH����O2��
B����ϡ����ϴ���Թ��ڱڵ�������Ag+2H��+NO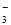 =Ag��+NO��+H2O
=Ag��+NO��+H2O
C����Ba(OH)2��Һ�еμ�NaHSO4��Һ�����ԣ�Ba2����2OH����2H����SO ��BaSO4����2H2O
��BaSO4����2H2O
D�� ������Һ��ͨ������CO2��2C6H5O- + CO2 + H2O  2C6H5OH + CO
2C6H5OH + CO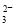
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ����
A��pH��ȵ�CH3COONa��NaOH��Na2CO3������ҺŨ�ȴ�С��ϵΪ��c(NaOH)��c(CH3COONa)��c(Na2CO3)
B��0.1 mol/L��NaHA��Һ����pH��4��c(HA��)��c(H��)��c(H2A)��c(A2��)
C��������������ʵ���Ũ�ȵ�NaX������HX��Ϻ����Һ��c(Na��)��c(HX)��c(X��)��c(H��)��c(OH��)
D��pH��11��NaOH��Һ��pH��3�Ĵ�����Һ�������ϣ�����ʯ����Һ�ʺ�ɫ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com