
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||||||||||||
| ⑧ | ⑨ | ⑩ | |||||||||||||||
 ;
;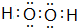 ,故答案为:
,故答案为: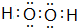 ;
;

科目:高中化学 来源: 题型:
| A、少量的金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ |
| B、铝片投入稀盐酸中:Al+6H+═Al3++3H2↑ |
| C、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-═BaSO4↓ |
| D、氧化铝溶于烧碱溶液:Al2O3+2OH-═AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Na2O2固体中含离子总数为4NA | ||
| B、标准状况下,22.4L己烷中共价键数目为19NA | ||
| C、由乙烯和环己烷组成的混合物28g,含电子数为16NA | ||
D、1L浓度为1mol/L的Na2CO3溶液中含有的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
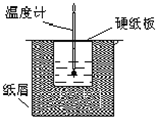 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列实验操作或对实验事实的描述正确的有
(1)下列实验操作或对实验事实的描述正确的有| 气体 | O2 | Cl2 | NH3 |
| 分液漏斗中试剂 | H2O | 浓氨水 | |
| 圆底烧瓶中试剂 | KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
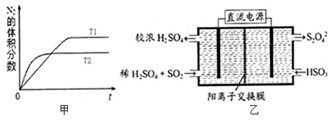 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA |
| B、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| C、含有NA个氩原子的氩气在标准状况下的体积约为11.2L |
| D、标准状况下,11.2L H2O2含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com