
【题目】已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
【答案】B
【解析】
A. 燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物所放出的热量,所以H2的燃烧热为1/2×571.6kJ/mol,故A错误;
B. 令H2(g)和CH3OH(l)的质量都为1g,则1g氢气燃烧放热为1/2×1/2×571.6=142.45kJ,1gCH3OH燃烧放热为1/32×1/2×1452=22.68kJ,所以H2(g)放出的热量多,故B正确;
C. 中和热是强酸强碱的稀溶液完全反应生成1mol水时放出的热量,故C错误;
D.2H2(g)+O2(g)═2H2O(l)△H=571.6kJmol-1改写为3H2(g)+3/2O2(g) ═ 3H2O(l) △H=(3/2×571.6)kJmol1,2CH3OH(l)+3O2(g) ═ 2CO2(g)+4H2O(l) △H=1452kJmol1改写为CO2(g)+2H2O(l) = CH3OH(l)+3/2O2(g)) △H=+(1/2×1452)kJmol1改写后的方程相加即得3H2(g)+CO2(g) = CH3OH(l)+H2O(l),所以其△H═(3/2×571.6)+(1/2×1452)=131.4kJmol1,故D错误;
故选B。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )

A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素(CO(NH2)2·H2O2)是过氧化氢水溶液与尿素的加和物,兼有尿素和过氧化氢的性质,是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。某化学小组同学用低浓度的双氧水和饱和尿素[CO(NH2)2]溶液在30℃条件下用右图装置合成过氧化尿素。请回答下列问题:
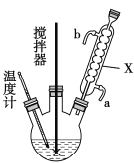
(1)仪器X的名称是______________;
(2)制备过氧化尿素的化学方程式为_______________________,反应时采取的受热方式为_____________;
(3)搅拌器不能选择铁质材料的原因是______________________
(4)过氧化尿素中活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品8.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL6mol·L-1H2SO4,然后用0.2000mol·L-1KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液与尿素不反应)。三次滴定平均消耗KMnO4溶液20.000mL:
①请完善滴定时反应的离子方程式:__MnO![]() +___H2O2+______==_______________
+___H2O2+______==_______________
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量_______(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量_______(填“合格”或“不合格”),活性氧的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同温同压下,H2 (g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件下的ΔH相同
2HCl(g)在光照和点燃条件下的ΔH相同
B. 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
C. 已知:①2H2(g) +O2(g)![]() 2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)
2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)![]() 2H2O(l)ΔH=-b kJ·mol-1,则a>b
2H2O(l)ΔH=-b kJ·mol-1,则a>b
D. 已知:①C(s,石墨)+O2 (g)![]() CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)
CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)![]() CO2 (g)ΔH=-395.0 kJ·mol-1,则C(s,石墨)
CO2 (g)ΔH=-395.0 kJ·mol-1,则C(s,石墨)![]() C(s,金刚石)ΔH= -1.5 kJ·mol-1
C(s,金刚石)ΔH= -1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如下:
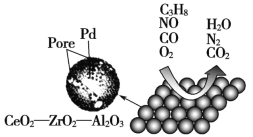
(1)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是_______________。
(2)图中互为等电子体的两种气体分子是_____________。
(3)C3H8中所有碳原子的杂化方式是___________。
(4)图中属于非极性的气体分子是_______________________。
Fe、Mn元素的部分电离能数据列于下表中
元素 | Fe | Mn | |
电离能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是_____________。
(6)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为_____________,[Ni(CO)4]的配体是_________,配位原子是__________。
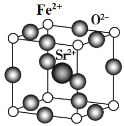
(7)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有______个。
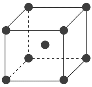
(8)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为______________g·cm-3(用来a、b、NA表示计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中山大学化学科研团队首次将CsPbBr3纳米晶锚定在氨基化RGO包覆的α—Fe2O3(α—Fe2O3/Amine—RGO/CsPbBr3),构筑Z—Scheme异质结光催化剂,可有效降低电荷复合,促进电荷分离,从而提升光催化性能。光催化还原CO2和氧化H2O的反应路径如图。下列说法正确的是( )
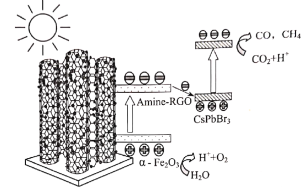
A.该路径能量转化形式为电能→化学能
B.该光催化转化反应可以阻止温室效应
C.“CsPbBr3纳米晶”表面发生了还原反应
D.该催化转化的总反应涉及到非极性共价键、极性共价键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参素(I)是一种具有改善心脏功能、抗血栓形成、促进组织的修复与再生等多种作用的药物。该药物的一种合成路线如下:
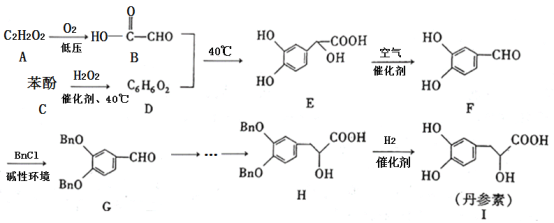
已知:![]() 代表苄基(
代表苄基(![]() )
)
请回答下列问题:
(1)![]() 的结构简式为_______,
的结构简式为_______,![]() 中所含官能团的名称为羟基、______。
中所含官能团的名称为羟基、______。
(2)![]() 的反应类型为_______,该反应的目的是________。
的反应类型为_______,该反应的目的是________。
(3)写出![]() 的化学方程式:________。
的化学方程式:________。
(4)苯酚与![]() 反应可以制备物质
反应可以制备物质![]() (
(![]() )。
)。![]() 是
是![]() 的同系物,相对分子质量比
的同系物,相对分子质量比![]() 大14。则符合下列条件的
大14。则符合下列条件的![]() 的同分异构体有______种(不考虑立体异构)。
的同分异构体有______种(不考虑立体异构)。
①苯环上只有两个取代基 ②能与![]() 溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
其中核磁共振氢谱有6组峰,且峰面积之比为![]() 的结构简式为________(写出一种即可)。
的结构简式为________(写出一种即可)。
(5)参照丹参素的上述合成路线,以![]() 为原料,设计制备
为原料,设计制备![]() 的合成路线:____________。
的合成路线:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com