
下列离子方程式与所述事实相符且正确的是( )
A.在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:
Mn2++ClO-+H2O===MnO2↓+Cl-+2H+
B.用稀硝酸清洗做过银镜反应的试管:Ag+NO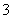 +4H+===Ag++NO↑+2H2O
+4H+===Ag++NO↑+2H2O
C.向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:
2Cl-+2H2O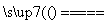 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
科目:高中化学 来源: 题型:
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
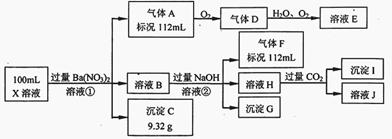
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
若要用实验证明该阴离子是否存在,最可靠的化学方法是_____________。
(2)尽量用离子方程表达下列反应:
①中生成气体A:_____________。
②中生成溶液H:_____________。
③中产生的气体F遇氯气产生白烟:_____________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的检验方法正确的是( )
A.向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42-离子
B.向某混有KI杂质的溶液中加入足量FeCl3溶液,用CCl4萃取,在无色的水层中加入氯水,溶液呈橙黄色,则该溶液中含有Br-
C.向某白色固体粉末中滴加稀盐酸,产生使澄清石灰水变浑浊的气体,则原固体粉末中一定含有CO32-或者HCO3-离子
D.某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子或离子在指定的分散系中能大量共存的一组是
A.空气 SO2、NO、NO2
B.KNO3溶液 Fe2+、H+、I-
C.NaHCO3溶液 Ca2+、OH-、Cl-
D.由水电离产生的c(H+) = 10-11mol·L-1的溶液 K+、SO42-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
(填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A. NaHSO4 溶液与Ba(OH)2溶液反应至中性:
2H++SO42-+Ba2++2OH-=BaSO4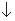 +2H2O
+2H2O
B. 向FeCl2溶液中通入氯气:Fe2++ Cl2= Fe3++2Cl-
C. 向Ca(ClO)2溶液中通入过量的SO2:ClO-+ SO2+ H2O= HClO+ HSO3-
D. FeSO4酸性溶液中加H2O2: 2Fe2++ H2O2= 2Fe3++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
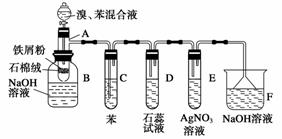
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):_________________________________________。
(2)试管C中苯的作用是__________________。反应开始后,观察D和E两试管,看到的现象为________________________________________________________________________。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是
________________________________________________________________________。
(4)在上述整套装置中,具有防倒吸作用的仪器有________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将有机物完全燃烧,生成CO2和H2O。将12 g该有机物完全燃烧后的产物通过浓H2SO4,浓H2SO4增重14.4 g,再通过碱石灰,碱石灰增重26.4 g。该有机物分子式为( )
A.C4H10 B.C2H6O
C.C3H8O D.C2H4O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com