
����Ŀ������ͭ���Ʊ�ʵ���ǻ�ѧʵ���ѧ��һ������ʵ�飬ijѧϰС���������������ʵ�鷽����
��1��ʵ��һ��
��ͭ������ϡ���ᷴӦ��ʵ������ͭ��Ũ�������ʹ֮��ȫ��Ӧ������Һͨ���������ᾧ�Ȳ����õ�����ͭ���塣
��������ʵ��ͷ�Ӧ���Ƚ�Ũ������ϡ��������ʣ�Ũ���������
��2���÷�Ӧ�Ļ�ѧ����ʽΪ��
��3��ʵ�����
�Կ���Ϊ��������һ����������������������ֱ��ͨ�뵽ͭ����ϡ����Ļ�����У��䷴Ӧԭ��Ϊ2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ������Ӧ����̫�����������¶ȵ�80��90�棬��Ӧ��Ȼ����������ͭ�ۺ�ϡ����Ļ�����м�������Fe2(SO4)3��Һ�����������Լӿ졣
Fe2(SO4)3����������
��4���õ��Ļ��Һ�������������������е�������Һ��pH =2��4��ʹFe3+ �γ�Fe(OH)3��������ȥ��
A.NaOH
B.CuO
C. CuCO3
D.Fe
��5��������������ݣ���������ʵ�鷽���������ۣ����±���
ʵ �� ��һ�� | ʵ �� ������ | |
��Ҫ�ŵ� | ������� | ��ԭ�ϳ��ת��Ϊ��Ʒ |
��Ҫȱ�� |
���𰸡�
��1��ǿ������
��2��Cu+2H2SO4 ��Ũ��= CuSO4+SO2��+ 2H2O
��3��������
��4��B,C
��5�����ж������ŷ�,����û��ȫ��ת��Ϊ��Ʒ����ͭ,��������ɫ��ѧԭ��,��������϶�,����ͭ������ܲ�̫����
���������⣺��1��ͭ����ϡ���ᷴӦ������Ũ���ᷴӦ������Cu��2H2SO4(Ũ) ![]() CuSO4��SO2����2H2O������Ũ��������Ժ�ǿ�����ԣ���2��Cu��2H2SO4(Ũ)
CuSO4��SO2����2H2O������Ũ��������Ժ�ǿ�����ԣ���2��Cu��2H2SO4(Ũ) ![]() CuSO4��SO2����2H2O��
CuSO4��SO2����2H2O��
��3������ʵ�����������������������Լӿ죬����������������
��4������pH���������������ʣ�����ʵ��Ŀ�ģ��������ʵ�״̬�Dz�����ˮ�Ĺ��壬��ѡ��BC�������⣻
(5)ʵ��һ����SO2��SO2�ж����Ի�����Ӱ�죬ֻͭ��Ũ���ᷴӦ�����ŷ�Ӧ�Ľ��У�Ũ�����Ũ�Ƚ��ͣ���Ӧ����ֹͣ��������������ࣻʵ������跱��������ͭ�����л���Fe2����Fe3������������
�����㾫�������û�ѧʵ��������Ⱥ�˳�����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��ѧʵ��˳����ѭ�����������ϡ�ԭ�������ҡ�ԭ���ȡ���������ԭ�������ȷš�ԭ��Һ���ӡ�ԭ�����������ԣ�װ��ҩƷǰ���У�ԭ���ƾ��ƣ�����װ����Ϻ��ٵ�ƾ��ƣ�ԭ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������������Һ�����廯����Һ����ˮ�Ļ��Һ���������ǵ���ȷ����������(����)
A. ��Һ������B. ��ȡ����Һ
C. ��Һ����ȡD. ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����Ʒ����������
A. ��ȥCO2�����л��е�HCl������̼��������Һ
B. ������CCl4�Ļ�����Һ
C. ����NaCl��KCl��Һ����ɫ��Ӧ
D. ����ijδ֪��Һ�е�SO42-������ϡ�����ữ��BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.�����ͬ��Ũ�Ⱦ�Ϊ0.1 mol?L��1��NaOH��Һ����ˮ���ֱ�ϡ��m����n������Һ��pH�����9����m��n
B.�мס�������ˮ��Һ����ü�pH=a���ҵ�pH=a+1�����������Һc��H+��֮��Ϊ10��1
C.��ͬ�¶��£�0.2 mol?L��1������Һ��0.1 mol?L��1������Һ��c��H+��֮��Ϊ2��1
D.��֪һ���¶��£�������Һ�����ʵ���Ũ��Ϊc�������Ϊ����K= ![]() �����������������ƹ��壬��CH3COOH?CH3COO��+H+�����ƶ�������С��K��С
�����������������ƹ��壬��CH3COOH?CH3COO��+H+�����ƶ�������С��K��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ͬѧ��ѧϰ�˰������ʺ����ۣ�������ȵ�˼�룬��Ȼ�������л�ԭ�ԣ��ܷ���H2������ԭCuO�أ��������ʵ����ȡ������̽���������⣺
��һ����ȡ����
��1��д��ʵ����ȡ�����Ļ�ѧ����ʽ��
��2����ͬѧģ���ű���ʳ��ˮ�ռ������ķ����������ű����Ȼ����Һ�ķ����ռ�����������Ϊ���ܷ�ﵽĿ�ģ�����ܡ�������������
��3����������С����ijͬѧ���������ʵ��װ�ã��гּ�β������װ��δ��������̽�������Ļ�ԭ�ԣ�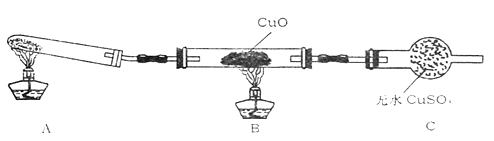
��װ�����������һ��ȱ�ݣ�Ϊ��֤ʵ������ȷ�ԣ��Ը�װ�õĸĽ���ʩ����
��4�����øĽ����װ�ý���ʵ�飬�۲쵽CuO��Ϊ��ɫ���ʣ���ˮCuSO4����ɫ��ͬʱ����һ������Ⱦ�����塣д��������CuO��Ӧ�Ļ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵����A��B��C��D��E������A��Cԭ�Ӷ�������δ�ɶԵĵ����ӣ�D�Ķ�����������C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ�� B��C���⻯��ķе������ͬ����������Ԫ���⻯��ķе�ߣ�E��ԭ������Ϊ24��ECl3����B��C���⻯���γ�����λ��������������������ʵ���֮��Ϊ2��1������������λ����磮���������������ش��������⣨����ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ��
��1��A��B��C�ĵ�һ��������С�����˳��Ϊ ��
��2��B���⻯��ķ��ӿռ乹���� �� ������ԭ�ӵ��ӻ���ʽ�� ��
��3��AC2�ĵ���ʽ �� �����ӣ�����ԡ��Ǽ��ԡ�����һ����B��C��ɵĻ�������AC2��Ϊ�ȵ����壬�仯ѧʽΪ
��4��E�ĺ�������Ų�ʽ�� �� ECl3��B��C���⻯���γɵ������Ļ�ѧʽΪ ��
��5��B������������Ӧ��ˮ�����ϡ��Һ��D�ĵ��ʷ�Ӧʱ��B����ԭ����ͼۣ��÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10mLpH=3�Ĵ�����Һ�м�ˮϡ�ͺ�����˵����ȷ���ǣ� ��
A.��Һ�е������ӵ���Ŀ����
B.��Һ�� ![]() ����
����
C.����ĵ���̶�����c��H+��������
D.�ټ���10mLpH=11��NaOH��Һ�����Һ��pH=7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����14�֣�H2S��SO2��Ի��������彡�����������Σ������ҵ�ϲ�ȡ���ַ���������Щ�к�������ŷţ��ش����з����е����⡣ ��H2S�ij�ȥ
����1��������H2S��ԭ��Ϊ��
H2S+Fe2(SO4)3![]() S��+2FeSO4+H2SO4
S��+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
��1����˾�����ʱ��FeSO4����������������ʱ��5��105�����þ�����������
��2����ͼ3��ͼ4�ж�ʹ����˾����������Ϊ������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ������ 
��3������2����һ�������£���H2O2����H2S ���Ųμӷ�Ӧ��n(H2O2)/n(H2S)�仯���������ﲻͬ����n(H2O2)/n(H2S)=4ʱ����������ķ���ʽΪ��
��4����SO2�ij�ȥ ����1��˫�������NaOH����SO2 �� ����CaOʹNaOH����
NaOH��Һ ![]() Na2SO3
Na2SO3
д�����̢ٵ����ӷ���ʽ����CaO��ˮ�д�������ת����
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s) ![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
��ƽ���ƶ��ĽǶȣ��������̢�NaOH������ԭ����
��5������2���ð�ˮ��ȥSO2��֪25�棬NH3��H2O��Kb=1.8��105 �� H2SO3��Ka1=1.3��102 �� Ka2=6.2��108������ˮ��Ũ��Ϊ2.0 mol��L-1 �� ��Һ�е�c(OH)=mol��L1����SO2ͨ��ð�ˮ�У���c(OH)����1.0��107 mol��L1ʱ����Һ�е�c( ![]() )/c(
)/c( ![]() )=��
)=��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����300mL���ܱ������У��������۲�����һ������CO���壬һ�������·�����Ӧ��Ni��s��+4CO��g��Ni��CO��4��g������֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ�����
�¶�/�� | 25 | 80 | 230 |
ƽ�ⳣ�� | 5��104 | 2 | 1.9��10��5 |
����˵������ȷ���ǣ� ��
A.��������Ni��CO��4��g���ķ�ӦΪ���ȷ�Ӧ
B.25��ʱ��ӦNi��CO��4��g��Ni��s��+4CO��g����ƽ�ⳣ��Ϊ2��10��5
C.80��ﵽƽ��ʱ�����n��CO��=0.3mol����Ni��CO��4��ƽ��Ũ��Ϊ2 mol/L
D.��80��ʱ�����ijʱ�̣�Ni��CO��4��COŨ�Ⱦ�Ϊ0.5 mol/L�����ʱv��������v���棩
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com