
| A.该反应已停止 |
| B.单位时间内氮气的消耗速率等于氢气的生成速率 |
| C.3v(H2)=2v(NH3) |
| D.c(H2) :c(N2) :c(NH3) =" 7" :9 :2 |
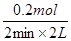 =0.05 mol/ (L·min)。
=0.05 mol/ (L·min)。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源:不详 题型:单选题
 H2(g)+I2(g)在密闭容器中进行,当__________不随时间变化时,才能说明反应已达到平衡( )
H2(g)+I2(g)在密闭容器中进行,当__________不随时间变化时,才能说明反应已达到平衡( )| A.容器内压强 | B.平均相对分子质量 |
| C.各成分含量 | D.混合气体颜色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是: 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )
2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )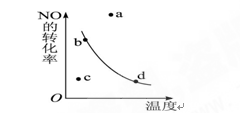
| A.a | B.b | C.c | D.d |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是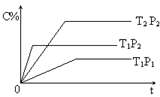
| A.T1 <T2 P1>P2 m+n<P Q<0 | B.T1>T2 P1<P2 m+n>P Q>0 |
| C.T1<T2 P1<P2 m+n<P Q>0 | D.T1>T2 P1<P2 m+n>P Q<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) ΔH<0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )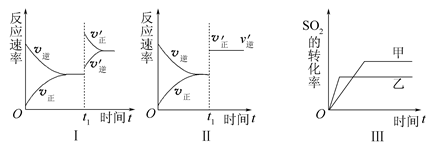
| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
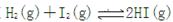 达到平衡状态时的标志是
达到平衡状态时的标志是| A.混合气体的体积恒定不变 |
| B.混合气体的颜色不再改变 |
| C. H2、I2、HI的浓度相等 |
| D.I2、H2这两种气体在混合气体中的体积分数相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应达平衡时N2的转化率为10% |
| B.反应进行到10 s末时,H2的平均反应速率是0.03 mol·(L·s)-1 |
| C.该反应达到平衡时,N2的平衡浓度为0.45 mol/L |
| D.该反应达到平衡时的压强是起始时压强的0.95倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
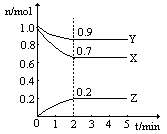
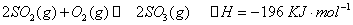 时,在2L固定容积的密闭容器中充入2mol
时,在2L固定容积的密闭容器中充入2mol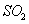 和2mol
和2mol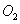 ,10分钟后达到平衡,
,10分钟后达到平衡,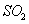 浓度和时间关系如图。
浓度和时间关系如图。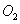 的平均反应速率为
的平均反应速率为 A.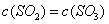 | B.气体总物质的量不变 |
C.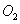 的浓度保持不变 的浓度保持不变 | D.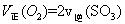 ) ) |
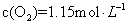 ,请在图上画出15-25分钟
,请在图上画出15-25分钟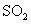 的浓度变化曲线。
的浓度变化曲线。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com