
| ||
| 1L |
| c(H3O+)��c(OH-) |
| c(H2O) |
| 10-14 |
| 55.6 |
| c(H3O+)��c(O2-) |
| c(OH-) |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��HCl��Һ�����϶������ |
| B��CH3COOH��Һ�����϶������ |
| C�����߲������������� |
| D�����Ƚ����߲����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ƽ�ⳣ��HA��HB |
| B���������pH��HA��HB���Ũ�ȵ�NaOH��Ӧ��HA���ĵ�NaOH�� |
| C���������pH��HA��HB���������Zn��Ӧ��HA��Ӧ���ʴ� |
| D�����е�Ũ�ȵ�NaA��NaB�������NaA��NaB |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1mol/LCH3COOH��Һ��pH��1��CH3COOH?CH3COO-+H+ |
| B����NO2��������ˮ�У���ɫ��dz��2NO2��g��������ɫ��?N2O4��g������ɫ����H��0 |
| C��������ϡ���ᣬ��Һ��ƣ�3Fe+8H++2NO3-?3Fe2++2NO2+4H2O |
| D����Na2CO3��Һ�е����̪����Һ��죺CO32-+H2O?HCO3-+OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��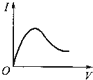 | B��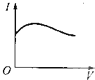 | C��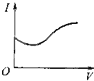 | D��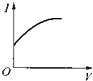 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| �� | �� | �� | �� | |
| ��Һ | pH=4��NH4Cl | pH=4������ | 0.1mol?L-1�Ĵ��� | 0.1mol?L-1��NaOH |
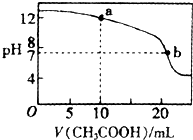
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1 molCH4ȼ�շų�������ΪCH4��ȼ���� |
| B��Na2SO3��H2O2�ķ�ӦΪ������ԭ��Ӧ |
| C�������ʵ����ı��ͱ�����ȼ�������ĵ�O2������ͬ |
| D��BaSO4��ˮ��Һ�����磬��BaSO4��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ˮ���ܵ����H+�Ļ����ﶼ���� |
| B��BaSO4������ˮ����BaSO4���ǵ���� |
| C��CO2����ˮ�ܵ��磬��CO2�ǵ���� |
| D������NaCl���岻���磬��NaCl�ǵ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com