
下列说法正确的是( )
A. 分子晶体中,共价键键能越大,分子的熔、沸点越高
B. pH=4的CH3COOH和NH4Cl溶液中,水的电离程度相同
C. 用pH试纸测定溶液pH的正确操作是,将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是
A. X、R的最高化合价相同
B. 简单离子的半径:X>Y>Z
C. Y、Z、R最高价氧化物对应水化物相互之间可以发生反应
D. 电解熔融的X与Z组成的化合物可以得到单质Z
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:简答题
湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。一种由铜镉渣生产金属镉的流程如下:
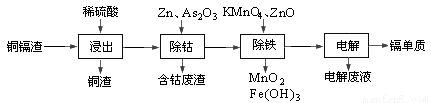
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol/L计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是__________________。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3。该微电池的正极反应式为_____。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
① 除铁过程中,理论上参加反应的物质n(KMnO4)∶n(Fe2+)=_________。
② 除铁时加入ZnO控制反应液pH的范围为________________。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:_____________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_____。
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三2月联考化学试卷(解析版) 题型:简答题
(18分)绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
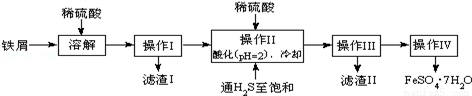
查询资料,得有关物质的数据如下:
25℃时 | pH值 | 25℃时 | pH值 |
饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(1)写出Fe和Fe2O3在硫酸溶液中发生反应的离子方程式为____、 ______ 、 __________;
(2)操作II中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②_________;③在溶液中用硫酸酸化至pH=2的目的是___________.
(3)操作IV的顺序依次为_____________、____________、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___________.
(5)常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O Fe(OH)2+2H+的平衡常数为:_______________(保留1位小数);
Fe(OH)2+2H+的平衡常数为:_______________(保留1位小数);
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三2月联考化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是( )
A. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42- 沉淀完全:2Al3+ + 3SO42- + 3Ba2+ + 6OH-=2Al(OH)3↓ + 3BaSO4↓
B. (NH4) 2 Fe(SO4)2溶液与过量NaOH溶液反应: Fe2++2OH-═Fe(OH)2↓
C. 澄清石灰水中加少量NaHCO3: Ca2+ + 2 OH- + 2HCO3-═CaCO3↓+2H2O+CO32-
D. 向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省淮安市高一上学期期末调研测试化学试卷(解析版) 题型:实验题
Ⅰ.实验室可以用二氧化锰和浓盐酸反应制取氯气,方程式如下:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,下图是某学生设计的试验室制备干燥Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题:
MnCl2+Cl2↑+2H2O,下图是某学生设计的试验室制备干燥Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题:
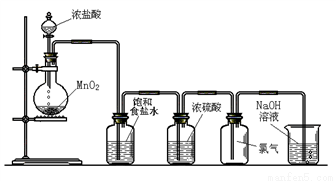
(1)该实验中还缺少一种仪器,这种仪器是_____________;
(2)饱和食盐水的作用是____________________;
(3)氯气与冷的氢氧化钠溶液反应生成NaCl、NaClO和H2O,与热的氢氧化钠溶液按照下面的反应进行:____________________
Cl2+ NaOH(热) - NaCl+ NaClO3+ H2O,请配平上述反应方程式;
(4)8.7 g MnO2和足量的浓盐酸反应,其中被氧化的HCl的物质的量为_________mol。
Ⅱ.某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验。
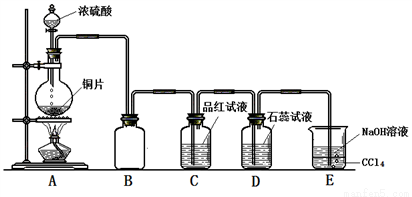
(1)B是用来收集实验中生成的气体的装置,但未将导管画全,请把导管补充完整_____________;
(2)D中的现象是_____________________;
(3)E中NaOH溶液的作用是_________________;
(4)下列药品中能够用来验证反应停止后的烧瓶中有H2SO4剩余的是__________(填字母编号)。
a.BaCl2溶液 b.NaHCO3粉末 c.Ba(NO3)2溶液 d.银粉
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省淮安市高一上学期期末调研测试化学试卷(解析版) 题型:选择题
常见物质的转化是化学学习的重要内容之一。下列各组物质的转化关系中不全部是通过一步反应完成的是
A. Na→NaOH→Na2CO3→NaCl B. Al→Al2O3→Al(OH)3→AlCl3
C. Fe→Fe(NO3)3→Fe(OH)3→Fe2O3 D. S→ SO2→ SO3→ H2SO4
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三上学期期末学分认定考试B卷化学试卷(解析版) 题型:选择题
在容积为2L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
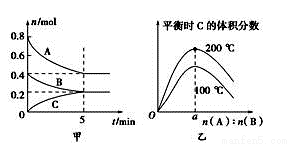
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期二调考试理综化学试卷(解析版) 题型:选择题
己知某温度下,Ksp(AgCl)=1.56×10-10mol2/L2,Ksp(Ag2CrO4)=1×10-12mol3/L3,下列叙述正确的是( )
A. 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B. 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
C. 向0.001mol/L的K2CrO4溶液中加入等体积的0.002mol/L AgNO3溶液,则CrO42-时完全沉淀
D. 将0.00lmol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L K2CrO4溶液,则先产生AgCl沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com