

 .
.分析 (1)NO与氢氧化钠溶液不反应,SO2是酸性氧化物,能与氢氧化钠溶液反应生成亚硫酸钠和水;
(2)在②2NO+6Ce(SO4)2+4H2O═3Ce2(SO4)3+2HNO3+3H2SO4中,N元素由+2升高到+5价,Ce元素由+4降低到+3价;(3)由流程图可知,装置Ⅱ加入Ce4+,装置Ⅲ产生Ce4+;根据SO2对大气的危害分析回答;
(4)该反应中,Ce2(SO4)3→Ce(SO4)2,Ce元素由+升高到+4价,Ce2(SO4)3是还原剂,NaHSO3→Na2S2O4,S元素由+4降低为+3,NaHSO3是氧化剂;
(5)根据NH3+HNO3=NH4NO3结合n=$\frac{m}{M}$、V=n•Vm计算.
解答 解:(1)NO与氢氧化钠溶液不反应,SO2是酸性氧化物,能与氢氧化钠溶液反应生成亚硫酸钠和水,化学方程式为SO2+2NaOH=Na2SO3+H2O,
故答案为:SO2+2NaOH=Na2SO3+H2O;
(2)在②2NO+6Ce(SO4)2+4H2O═3Ce2(SO4)3+2HNO3+3H2SO4中,N元素由+2升高到+5价,Ce元素由+4降低到+3价,用双线桥表示转移电子情况为 ,
,
故答案为: ;
;
(3)由流程图可知,装置Ⅱ加入Ce4+,装置Ⅲ产生Ce4+,可以循环使用;NO有毒,可对大气造成污染,而SO2对大气造成污染,可导致酸雨的形成,
故答案为:Ce4+;减少酸雨的形成;
(4)该反应中,Ce2(SO4)3→Ce(SO4)2,Ce元素由+升高到+4价,Ce2(SO4)3是还原剂,NaHSO3→Na2S2O4,S元素由+4降低为+3,NaHSO3是氧化剂,因此氧化剂与还原剂的物质的量之比为2:1,
故答案为:2:1;
(5)每生产16tHN4NO3产品,至少需要氨气的质量为xt,则
NH3+HNO3=NH4NO3
17 80
xt 16t
$\frac{17}{80}=\frac{x}{16}$,解得x=3.4,
氨气的物质的量n=$\frac{3.4×1{0}^{6}g}{17g/mol}$=2×105mol,标准状况下V=n•Vm=2×105mol×22.4L/mol=4.48×106L,
故答案为:4.48×106.
点评 本题考查了无机化工生产流程图,为高频考点,涉及氧化还原反应、计算、电化学等知识,综合性强,侧重分析、计算能力的考查,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | n(CH3COOH) | B. | c(H+) | C. | c(H+)•c(OH-) | D. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀时,待镀金属连接电源负极,发生氧化反应 | |
| B. | 工业上电解NaCl水溶液制备钠,电解熔融态Al2O3制备Al | |
| C. | 往往将铁闸门与直流电源的负极相连,这是牺牲阳极的阴极保护法 | |
| D. | 电解精炼铜时,电解液选用硫酸酸化的硫酸铜,精炼过程中,Cu2+浓度降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、盐酸、碘酒和液氯都属于混合物 | |
| B. | 向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液,可制备Fe(OH)3胶体 | |
| C. | 熔融氯化钠,盐酸和铜都能导电,所以都属于电解质 | |
| D. | 一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)+c(C2O42-) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-6mol•L-1 | |
| B. | pH相等的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ | |
| C. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
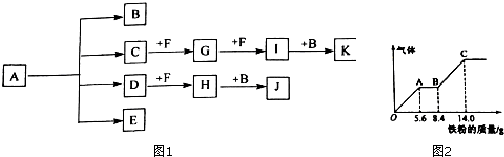
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
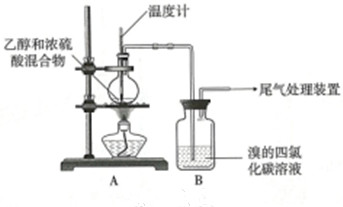
| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com