
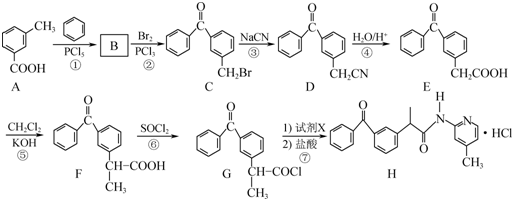
 +
+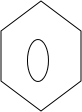 $\stackrel{PCl_{3}}{→}$
$\stackrel{PCl_{3}}{→}$ +H2O.
+H2O.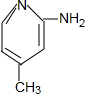 .
. (只写一种).
(只写一种).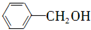 和
和 为原料制备
为原料制备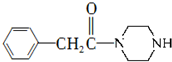 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用). 分析 (1)据F的结构简式判断所含官能团;
(2)据A与C的结构简式分析,可知A与苯环发生取代反应生成B,B为 ,B与Br2发生取代反应生成C,C与NaCN发生取代反应生成D,D被氧化生成E,据此分析;
,B与Br2发生取代反应生成C,C与NaCN发生取代反应生成D,D被氧化生成E,据此分析;
(3)据G和H的结构简式和X的分子式为C6H8N2可知,X为 ;
;
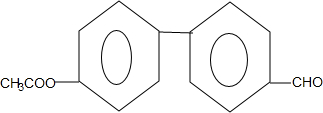
(4)E分子结构中除2个苯环外,还含有3个C原子核3个O原子,水解后产物之一既能发生银镜反应又与FeCl3溶液发生显色反应,说明含有酯基和醛基,且水解产物含有酚羟基,再结合分子中有6种不同化学环境的氢,且分子中含有两个苯环书写其同分异构体的结构简式;
(5)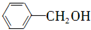 和
和 为原料制备
为原料制备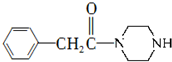 ,需要给
,需要给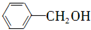 增长碳链,结合合成盐酸吡酮洛芬的反应③可知,将苯甲醇与HBr反应,再与NaCN反应,可以增长碳链,水解可得苯乙酸,再结合合成盐酸吡酮洛芬的反应⑥⑦分析.
增长碳链,结合合成盐酸吡酮洛芬的反应③可知,将苯甲醇与HBr反应,再与NaCN反应,可以增长碳链,水解可得苯乙酸,再结合合成盐酸吡酮洛芬的反应⑥⑦分析.
解答 解:(1)据F的结构简式可知,其含氧官能团有羰基和羧基,故答案为:羰基;羧基;(15分)
(2)据A与C的结构简式分析,可知A与苯环发生取代反应生成B,B为 ,A→B的化学方程式为
,A→B的化学方程式为 +
+ $\stackrel{PCl_{3}}{→}$
$\stackrel{PCl_{3}}{→}$ +H2O,B与Br2发生取代反应生成C,C与NaCN发生取代反应生成D,D被氧化生成E,
+H2O,B与Br2发生取代反应生成C,C与NaCN发生取代反应生成D,D被氧化生成E,
故答案为:①②③; +
+ $\stackrel{PCl_{3}}{→}$
$\stackrel{PCl_{3}}{→}$ +H2O;
+H2O;
(3)据G和H的结构简式和X的分子式为C6H8N2可知,X为 ,故答案为:
,故答案为: ;
;
(4)E的同分异构体中含有酯基和醛基,其水解产物含有酚羟基,再结合分子中有6种不同化学环境的氢,且分子中含有两个苯环,说明2个苯环直接相连,且酯基与醛基在对位,其同分异构体的结构简式为 ,
,
故答案为: ;
;
(5)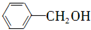 和
和 为原料制备
为原料制备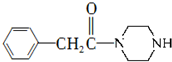 ,需要给
,需要给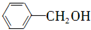 增长碳链,结合合成盐酸吡酮洛芬的反应③可知,将苯甲醇与HBr反应,再与NaCN反应,可以增长碳链,水解可得苯乙酸,再结合合成盐酸吡酮洛芬的反应⑥⑦可知其合成路线流程图为
增长碳链,结合合成盐酸吡酮洛芬的反应③可知,将苯甲醇与HBr反应,再与NaCN反应,可以增长碳链,水解可得苯乙酸,再结合合成盐酸吡酮洛芬的反应⑥⑦可知其合成路线流程图为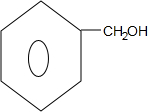 $\stackrel{HBr}{→}$
$\stackrel{HBr}{→}$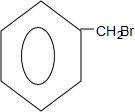 $\stackrel{NaCN}{→}$
$\stackrel{NaCN}{→}$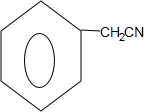 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$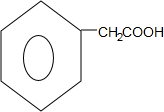 $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$
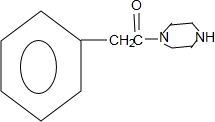 ,
,
故答案为: $\stackrel{HBr}{→}$
$\stackrel{HBr}{→}$ $\stackrel{NaCN}{→}$
$\stackrel{NaCN}{→}$ $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$ $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$

 .
.
点评 本题考查有机合成,通过合成路线流程图,结合官能团的性质分析各步转化,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应的限度决定了反应物物在该条件下的最大转化率 | |
| B. | 化学反应的限度可以通过改变条件而改变 | |
| C. | 构成原电池正极和负极的材料必须是两种金属 | |
| D. | 铜锌原电池工作时,若有13g锌被溶解,则电路中有0.4mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;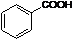 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新农村建设大量使用秸秆制取沼气,符合低碳理念 | |
| B. | 发霉的大米经过石蜡打磨后可以食用和出售 | |
| C. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全杀灭该病毒,其消毒原理和漂白粉消毒饮用水相同 | |
| D. | 卤水点豆腐、血液透析、静电除尘都是利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
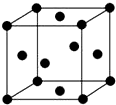 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 :可以表示二氧化碳分子,也可以表示水分子 :可以表示二氧化碳分子,也可以表示水分子 | |
| B. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| C. | 纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素 | |
| D. | 已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol•L-1的AgNO3溶液和1×10-4 mol•L-1 K2Cr04溶液混合,不会有Ag2CrO4沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(NH3)=0.17mol/(L•min) | D. | v(NH3)=0.01mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲用于浓盐酸和漂粉精制取并收集干燥的Cl2 | |
| B. | 乙用于测定盐酸的浓度 | |
| C. | 丙用于证明浓硫酸具有脱水性和强氧化性 | |
| D. | 丁用于制取金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com