


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2012-2013学年河北省保定市涞水县祖冲之中学高二(上)期中化学试卷(化学反应原理)(解析版) 题型:解答题
 O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.
O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省临沂市高二(上)期末化学试卷(解析版) 题型:解答题
| 时间(s) | 1 | 2 | 3 | 4 | |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 |
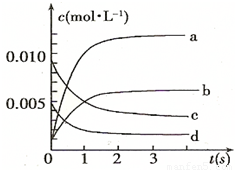
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省金华市兰溪一中高二(下)期中化学试卷(解析版) 题型:填空题

 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)| 时间/min | CH4(mol) | H20( mol) | CO (mol) | H2 (mol) |
| 0.40 | 1.00 | |||
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com