
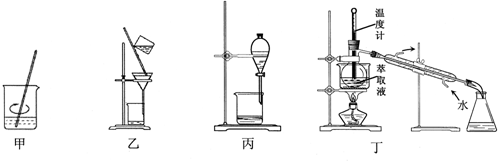
| A. | 用装置甲加稀H2SO4及H2O2氧化并用CCl4浸取 | |
| B. | 用装置乙过滤分离出浸取液 | |
| C. | 用装置丙分离得到碘的四氯化碳溶液 | |
| D. | 用装置丁分离萃取液中单质碘和四氯化碳 |
分析 A.实验室从废旧的含CuI/SiO2催化剂中提取碘,CuI具有还原性,应该用氧化性物质将碘离子氧化,然后加入萃取剂;
B.分离难溶性固体和溶液采用过滤方法;
C.碘在水的溶解度远远小于在四氯化碳中的溶解度,且四氯化碳和水不互溶,碘和四氯化碳不反应,可以采用萃取分液方法分离碘;
D.蒸馏时温度计测量馏分温度.
解答 解:A.实验室从废旧的含CuI/SiO2催化剂中提取碘,CuI具有还原性,应该用氧化性物质将碘离子氧化,且不能引进新的电子,然后加入萃取剂进行萃取,双氧水能将CuI氧化生成碘单质,符合条件,故A正确;
B.分离难溶性固体和溶液采用过滤方法,二氧化硅不溶于水,所以可以采用过滤方法分离浸取液,故B正确;
C.碘在水的溶解度远远小于在四氯化碳中的溶解度,且四氯化碳和水不互溶,碘和四氯化碳不反应,可以采用萃取分液方法分离碘,故C正确;
D.蒸馏时温度计测量馏分温度,温度计水银球应该位于支管口处,故D错误;
故选D.
点评 本题考查实验方案评价,为高频考点,明确实验原理是解本题关键,会根据物质的性质选取合适的分离提纯方法,易错选项是D.


 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
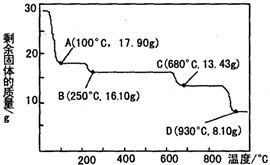
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3•H2O?NH4++OH- | K=1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 仪器 |
| A | 从食盐水中获得NaCl晶体 | 蒸发皿、玻璃棒、酒精灯 |
| B | 用稀H2SO4、Na2CO3溶液比较元素S与C的非金属性强弱 | 试管、胶头滴管 |
| C | 用8.0mol.L-1的盐酸配制 250mL1.5mol.L-1的盐酸 | 250m容量瓶,玻璃棒、烧杯 |
| D | 测定NaOH溶液的物质的量浓度 | 酸(碱)式滴定管,胶头滴管、锥形瓶、烧杯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子. ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.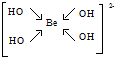 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6克钠与水反应时失去的电子数目为0.2NA | |
| B. | 1 L0.5mol•L-1 Na2SO4溶液中所含有的Na+离子数日为NA | |
| C. | 在标准状况下,22.4LNH3所含的氨分子数目为NA | |
| D. | 常温常压下2克氢气所含原子数日为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁片镀锌时,铁片与外电源的正极相连 | |
| B. | 反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 0.1mol•L-1的CH3COOH溶液加水稀释,溶液的pH和其中水的电离程度均增大 | |
| D. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 | |
| B. | 做衣服的棉、麻、蚕丝的主要成分都是纤维素 | |
| C. | 鸡蛋清中加人胆矾可以使蛋白质发生聚沉.加水后重新溶解 | |
| D. | 乙烯和氯乙烯都可以通过加聚反应得到高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
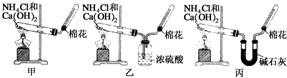 甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com