
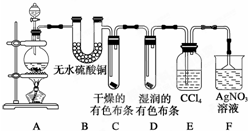
 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.分析 (1)实验室制备气体,连接装置后,第一步操作应该检验装置的气密性;实验室用MnO2与浓盐酸反应制取氯气;
(2)①从A制取的氯气中含有水蒸气,白色的无水硫酸铜与水反应生成蓝色的五水硫酸铜用来检测水的存在;
②氯气能使湿润的有色布条褪色,但是不能使干燥的有色布条褪色,次氯酸具有漂白性,氯气没有漂白性;
(3)氯气与水反应生成盐酸和次氯酸,只要验证盐酸不具有漂白性即可.
解答 解:(1)实验室制备气体,连接装置后,第一步操作应该检验装置的气密性;实验室用MnO2与浓盐酸反应制取氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:检验装置的气密性;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)①从A制取的氯气中含有水蒸气,白色的无水硫酸铜与水反应生成蓝色的五水硫酸铜,所以现象为:无水硫酸铜变蓝;
故答案为:无水硫酸铜变蓝;
②C中干燥的有色布条不褪色,D中湿润的有色布条褪色,即可证明氯气不具有漂白性,具有漂白性的是次氯酸;
故答案为:C中干燥的有色布条不褪色,D中湿润的有色布条褪色;
(3)氯气与水反应生成盐酸和次氯酸,使有色布条褪色的是次氯酸;如果盐酸具有漂白性,则:将一红色布条伸入稀盐酸溶液中,则红色布条褪色;
故答案为:可将一红色布条伸入稀盐酸溶液中,若红色布条不褪色,则证明使红色布条褪色的是HClO,而不是盐酸.
点评 本题考查了氯气的制取、性质及次氯酸的探究性实验的设计,明确氯气和次氯酸的性质是解题关键,注意分离物质方法选择的原则,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 最高价氧化物对应的水化物的碱性:丙>丁>戊 | |
| B. | 金属性:甲>丙 | |
| C. | 原子半径:丙<丁<戊 | |
| D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烷体积比是1:4 | B. | 丙炔与乙炔体积比是1:4 | ||
| C. | 乙烯与丁烷体积比是1:4 | D. | 乙烯与丁烯体积比是1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com